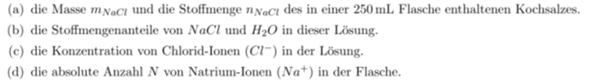Hallo Liebe Leute, kann mir einer bei dieser Aufgabe helfen:
Ein Hörsaal 1 hat die Abmessungen L = 12 m, B = 8 m, H = 3 m. Der Sauerstoffgehalt der Luft beträgt xO 2 = 0.20, der initiale CO 2 -Gehalt entspricht xCO 2 = 400 ppm. Desweiteren sind die Raumbedingungen ϑ = 23 ◦ C und p = 990 mbar. Der Hörsaal ist mit 50 hoch interessierten Studierenden und 1 Dozenten belegt. Alle anwesenden Personen haben pro Atemzug (Dauer Δt = 6 s) ein durchschnittliches Lungenvolumen von VL = 0.5 L unter Normbedingungen. Der Sauerstoffgehalt in der ausgeatmeten Luft hat sich um ΔxO 2 = 0.04 verringert. Der Stoffwechsel im Körper (pro Atemzug) erfolge vereinfachend gemäß folgender Reaktion (Zucker = C 6 H 12 O 6 ):
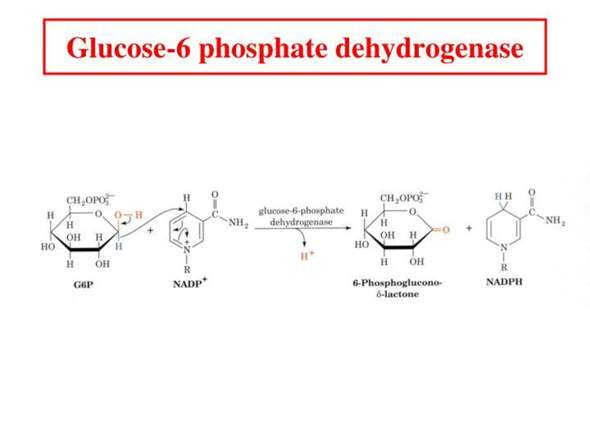
Zucker + Sauerstoff −→ Kohlendioxid + Wasser
(a) Fertigen Sie eine Skizze des beschriebenen Systems an, das den Prozess” Atmen“ darstellt sowie die dabei auftretenden (relevanten) Stoffe enthält.
(b) Stellen Sie die Reaktionsgleichung in Formelschreibweise inkl. der ausgleichenden stöchiometrischen Koeffizienten auf.
Berechnen Sie vor Beginn der Vorlesung (t = 0 h) für O 2 und CO 2 . . .
(c) . . . die Partialdrücke pi gemäß der Gleichung pi = p · xi (Gesetz von Dalton).
(d) . . . die Stoffmengenkonzentrationen ci in der Raumluft in mol/m³
(e) . . . die insgesamt vorliegenden Stoffmengen ni beider Komponenten im Raum.
(f) . . . die Stoffmenge ΔnO 2 , die pro Person und Atemzug verbraucht wird. 2
Berechnen Sie nach einer Stunde (t = 1 h) . . .
(g) . . . die Anzahl an Atemzügen, die innerhalb der Stunde von allen Anwesenden insgesamt getätigt werden.
(h) . . . die Stoffmengen an Sauerstoff und Kohlendioxid in [mol] sowie die Masse an Zucker in [g], die von allen Beteiligten in dieser Zeit verbraucht bzw. erzeugt wurden.
(i) . . . die Stoffmengen von O 2 und CO 2 , die nun im Raum vorhanden sind.
(j) . . . die aktuellen Konzentrationen von O 2 und CO 2 .
(k) Recherchieren Sie mit Quellenangabe einen MAK-Wert 4 von CO 2 und kommentieren Sie damit ihr berechnetes Ergebnis aus der vorigen Teilaufgabe.
Ich bin bis c) gekommen und auch hier weis ich nicht um meine Antwort richtig ist.