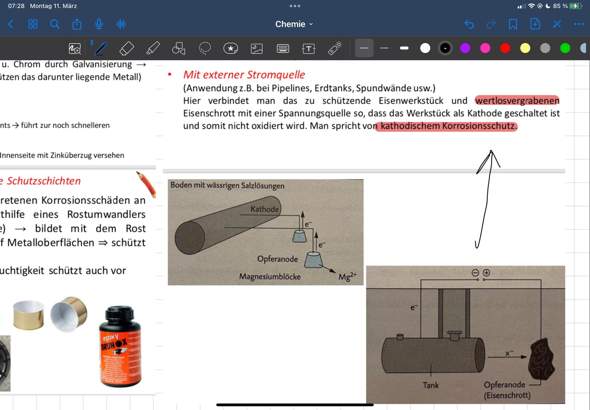
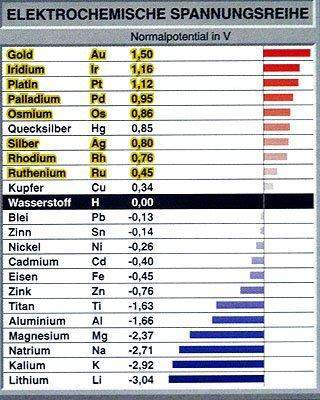
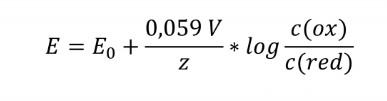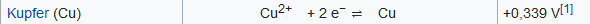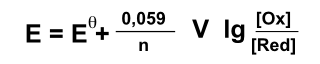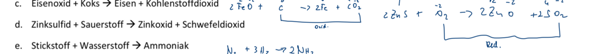Hallo, ich bin mir unsicher, ob die beiden miteinander reagieren würden.
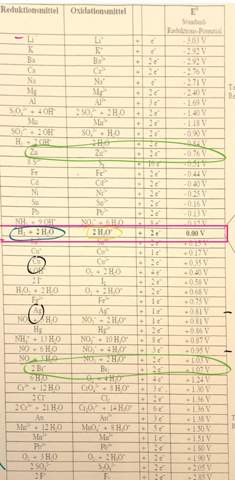
Mein Gedanke ist, es reagiert miteinander, weil der Abstand zwischen den beiden Teilchen in der Elektrochemischen Spannungsreihe klein ist und Sn als mittelstarkes Reduktionsmittel ein relativ starkes Bedürfnis hat, Elektronen an Fe^2+ abzugeben, wobei das Eisenion möglicherweise trotz des relativ niedrigen Bedürfnisses Elektronen aufzunehmen, dies tut, jedoch nicht so ausgeprägt, das sie jedesmal reagieren, aber häufig. (Keine Ahnung, ob das Sinn macht)
Ansonsten haben wir gelernt, dass man es auch mithilfe einer gedanklichen Diagonale in der Spannungsreihe untersuchen kann, jedoch weiß ich nicht, ob das immer funktioniert… Bei diesem Fall zeigt die Diagonale an, dass es nicht reagiert.
Vorerst danke für eure Hilfe! :)