Stabilitätskonstante berechnen?

wenn ich mithilfe dieser Gleichung die Stabilitätskonstante eines Komplexes berechnen möchte, woher weiß ich, welche Konzentration ich für c(Ox) einsetze?
Also ich habe 2 Halbzellen die über ein Diaphragma verbunden sind. In beiden Zellen ist jetzt zum Beispiel eine Kupfer-Lösung mit gleicher Konzentration und ich gebe in die eine Halbzelle jetzt Ammoniak hinzu, der mit dem Kupfer einen Komplex bildet. Das bedeutet die Konzentration an Kupfer wird hier geringer und es lässt sich aufgrund des Konzentrationsunterschiedes eine Spannung beobachten. Welche Konzentration muss ich den jetzt einsetzen? eigentlich doch die Konzentration von der Kupferlösung ohne die Zugabe des Ammoniaks oder?
1 Antwort
Nach Deiner Klarstellung hier eine vollständig durchgerechnete Antwort. Du hast also eine Cu²⁺/Cu-Konzentrationszelle aus einer Kathode mit c₀₀=0.1 mol/l Cu²⁺-Lösung. Auf der Anodenseite nimmst Du V₀=50 ml derselben Cu²⁺-Lösung (entsprechend einer Stoffmenge n=cV=5 mmol) und kübelst noch V₁=7.5 ml einer konzentrierten NH₃-Lösung dazu, die genau 0.1 mol NH₃ enthält. Dann hast Du in der Kathode V=V₁+V₂=57.5 ml, die 5 mmol Kupfer enthalten (c₀=n/V=5/57.5=0.0869 mol/l) und dazu noch c₁=n/V=0.1/57.5=1.74 mol/l NH₃.
In der Anodenlösung wird der größte Teil des Kupfers zum stabilen Tetraminkupfer(II)-Komplex reagieren:
Cu²⁺ + 4 NH₃ ⟶ [Cu(NH₃)₄]²⁺
und nur der Teil des Kupfers, der nicht komplexiert ist, kommt in die Nernst-Gleichung; das ist sehr viel weniger, als die nur durch Verdünnung erhaltene Zahl c₀. Für Konzentrationszellen hängt die Spannung ja nur von den Konzentrationen ab:
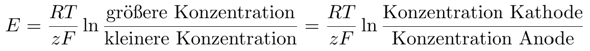
Die letztere Gleichsetzung gilt strenggenommen nur für Metalle; die werden ja in der konzentrierteren Zelle vom Ion zum Metall reduziert, in der verdünnterem vom Metall zum Ion oxidiert (anders gesagt: Die konzentriertere Lösung ist das Oxidationsmittel, die verdünntere das Reduktionsmittel, aber eigentlich finde ich diese Terminologie nur verwirrend).
Wir messen eine Spannung von E=0.402 V, außerdem wissen wir, daß die konzentriertere Kupferlösung eine Konzentration c₀₀=0.1 mol/l hat. Daraus können wir sofort die Konzentration des Kupfers in der Anodenflüssigkeit ausrechnen:
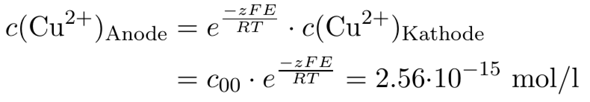
Die Konzentration von Cu²⁺ ist also astronomisch gering (knapp hundert Millionen Ionen in Deinem Gefäß), weil so gut wie alles Kupfer als Tetraminkomplex vorliegt, für die Nernst-Gleichung ist aber nur das Kupfer wirksam, das in der gleichen Form vorliegt wie in der Kathode, also unkomplexiert (bzw. als Aquokomplex).
Wir können uns auch die Komplexbildungskonstante des Tetraminkomplexes ausrechnen, dazu schreiben wir uns das Massenwirkungsgesetz an und überlegen uns:
- Die Cu²⁺-Konzentration kennen wir, die haben wir ja gerade aus der Spannung ausgerechnet, 2.56⋅10¯¹⁵ mol/l.
- Die [Cu(NH₃)₄]²⁺-Konzentration können wir mit der Einwaage-Konzentration gleichsetzen, also den ursprünglichen V₀=50 ml der 0.1 mol/l Lösung n=cV₀=5 mmol verdünnt auf V=V₀+V₁=57.5 ml, also c₀=n/V=0.0869 mol/l. Davon wäre theoretisch noch die Cu²⁺-Konzentration abzuziehen, aber das können wir uns schenken, weil sie so winzig ist.
- Beim Ammoniak müssen haben wir 0.1 mol in 57.5 ml, also c₁=1.74 mol/l. Davon müssen wir aber noch den Ammoniak abziehen, der für die Bildung des Tetramin-Komplexes verbraucht wurde, also c(NH₃)=c₁−4c₀=1.39 mol/l.
Und jetzt setzen wir den ganzen Schmarrn ein:
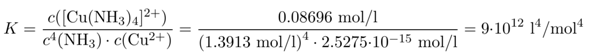
und bekommen einen erwartungsgemäß hohen Wert K=9⋅10¹² l⁴/mol⁴, das Gleichgewicht der Komplexbildung liegt ja ganz weit auf der Produktseite.
Paß auf, ich habe jedes Mal, wenn ich das durchgerechnet habe, ähnlich aber andere Werte herausbekommen. Hoffentlich stimmt es jetzt, aber wenn etwas faul ist, dann frag nach.



- Für die Nernst-Gleichung haben wir eine Konzentrationskette zwischen der Kathodenkonzentration c₀₀=0.1 mol/l und der Anodenkonzentration c=2.57⋅10¯¹⁵ mol/l, und die daraus resultierende Spannung E=RT/(zF)⋅ln(c₀₀/c)=0.402 V.
- Für die Komplexbildungsreaktion sind nur die Konzentrationen in der ammoniakhaltigen Lösung relevant. Das Gesamtkupfer wird durch die Verdünnung auf 0.0869 mol/l verdünnt und liegt fast ausschließlich als Komplex vor.
- Es ist durchaus möglich, daß in der Rechnung noch ein kleinerer Wurm drin ist; ich habe es dreimal gerechnet und dreimal leicht verschiedene Resultate bekommen (der Himmel weiß warum; als ich es gemerkt habe, waren die alten Rechnungen immer schon gelöscht). Größenordnungsmäßig sollte es aber stimmen.
Kann man das dann auch insgesamt auf alle beziehen, also dass immer die Konzentration eingesetzt werden muss, der man auch den Komplexbildner zugefügt hat?
Nein, zum fünfhundersten Mal: Die Konzentrationskette funktioniert mit unkomplexiertem Cu²⁺, in der einen Elektrode ist sind das die 0.1 mol/l, die Du hineingeschüttet hast, in der anderen ist das das Cu²⁺, das nach der Komplexbildung übrigbleibt.
Vielen Dank erstmal !, meine Frage war aber eher darauf gerichtet, welche Cu2+-Konzentration jetzt die c(Ox) darstellt. Die die nicht durch die Zugabe von Ammoniak verändert wurde oder die, die durch die Zugabe von Ammoniak verändert wurde? also zum Beispiel wenn man in einer Halbzelle 1mol/L hat und in der anderen dann halt 0,5mol/L weil das Volumen durch die Zugabe von Ammoniak verdoppelt wurde. Mein Lehrer hat da nämlich nur etwas zu gesagt wie: "nehmen sie die höhere Konzentration", das wurde in der Klausur dann auch gemacht, da war es aber falsch.
LG Xerox
Die relevante Konzentration ist die an freiem Cu²⁺, also dem Rest an Cu²⁺, der übrigbleibt, wenn der größere Teil vom NH₃ komplexiert wird.
Du hast ja eine Konzentrationszelle aus Cu²⁺ in verschiedenen Konzentrationen. In der Anodenflüssigkeit herrscht Cu²⁺-Mangel, deshalb wird die Kupferelektrode oxidiert und liefert verzweifelt Cu²⁺ nach, das vom Ammoniak aber wieder sofort aus dem Verkehr gezogen wird; das Komplexion [Cu(NH₃)₄]²⁺ nimmt nicht direkt an der elektrochemischen Reaktion teil (nur indirekt über das Gleichgewicht, über das es mit dem Cu²⁺ verbunden ist).
Aber ohne eine genauer Fragestellung kann ich nichts vorrechnen.
Folgende Werte sind gegeben: beide Kupferhalbzellen haben 50mL einer Kupfersulfat-Lösung mit einer Konzentration von 0,1mol/L. In eine der beiden Halbzellen werden 7,5mL Ammoniak-Lösung gegeben (diese 7,5mL entsprechen 0,1mol). Die gemessene Spannung beträgt 0,402V. Die Berechnung ansich kenne und kann ich, ich wundere mich nur, ob ich jetzt als c(Ox) in meiner oben mit angefügten Formel die Konzentration 0,1mol/L, also der Cu2+-Konzentration ohne die Ammoniak-Lösung verwende oder ob ich da 0,087mol/L einsetze (Die Konzentration der Kupfersulfat-Lösung nach Zugabe der 7,5mL Ammoniak-Lösung). Denn c(Ox) brauche ich schließlich um die Konzentration an freien Kupfer-Ionen zu berechnen.
Au, das sind blöde Zahlen. Ich habe die Antwort neu geschrieben und hoffentlich damit mehr Verwirrungen beseitigt als geschaffen.
Warum genau, nimmt man denn jetzt nochmnal die 0,087mol/L Kupferkonzentration anstelle der 0,1mol/L der nachbarzelle?