Faraday Gesetze anhand Diagramm sehen?
Hallo,
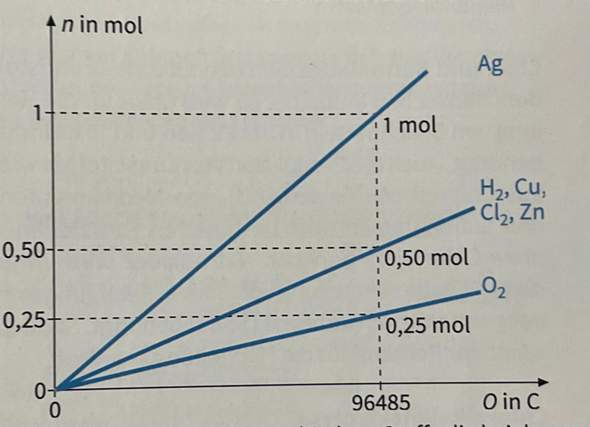
Was sind die wichtigsten Kernaussagen des Diagramms und wie werden dort die Faradayschen Gesetze wiedergegeben?
Viele Grüße
1 Antwort
Elektrochemie ist immer so ein um den heißen Brei reden, aber da noch keine Antwort vorliegt, versuche ich es mal:
Es geht bei Faraday um Elektrolyse von Lösungen/Elektrolyten und ursprünglich ging es um Abscheidungen von Massen/Volumen an Elektroden, ich werde es etwas weiter formulieren und spreche von Oxidation und Reduktion:
Das Diagramm sagt im Prinzip aus, dass ein Mol Ag^+ Ionen (einfach geladen) einen Ladung von 96845 Coulomb (eben 96845 Coulomb pro Mol = C/mol) aufweisen. Das ist die sogenannte Faraday-Konstante. Die Ladung ist positiv. Man kann also sehr salopp sagen: ein Mol Ag^+ ist 96845 mal positiv geladen. Wenn du nun 96845 mal negative Ladung auf ein Mol Ag^+ bringst, bekommst du ein Mol neutral geladenes Ag.
Was kann man also sagen: Die Menge an Stoff, die man erhält ist zunächst mal abhängig davon wie viel elektrische Ladung man einbringt. Wenn du z.B. nur 0.9 M Silber haben willst musst du weniger Ladung einbringen. (Und wenn man das ganze dann wissenschaftlich ausdrücken will, sagt man: Die Stoffmenge der elektrolytischen Zersetzungs-/Abscheidungsprodukte ist proportional zu der Menge an eingebrachter Elektrizität/Ladung). Und das ist schon das erste Faradaysche Gesetz. Sie gibt also an wie viele Ladung benötigt wird um ein Mol eines einwertigen Ions zu einem Mol Element zu reduzieren, aber man kann auch salopp sagen, sie gibt an wie viel Ladung auf einem Mol des Stoff "verteilt" ist.
Dann schaut man weiter. Was passiert da genau: In der Lösung liegen die entstehenden Elemente ja als Ionen vor. Wir haben also Ag^+, Cu^2+, Zn^2+, Cl- und H^+ bzw. O^2- (O^2- haben wir nicht vorliegen, aber in den Wassermolekülen ist es ja so, dass die größte Elektronendichte auf dem Sauerstoff liegt und beim Wasserstoff kaum Elektronendichte). Was muss also passieren:
Ag^+, das + gibt eine einfacher Ladung an. Das ist die Ladungszahl, hier halt 1. Ein einfach positiv geladenes Ion muss ein negatives Ladungsteilchen (ein Elektron) aufnehmen, damit Ag vorliegt. 96485 Coulomb reichen laut Grafik und Faraday-Konstante dafür aus, um ein Mol Ag^+ (also ein Mol einfach positiv geladener Teilchen, zu einem Mol des Elements zu reduzieren. (Ag^+ + e^- -> Ag).
Bei H^+ muss auch ein Ladungsteilchen aufgenommen werden. Allerdings liegt Wasserstoff als Molekül (H2) vor. 2 H^+ müssen also jeweils ein e^- aufnehmen, damit H2 entstehen kann (2 H^+ + 2 e^- -> H2). Insgesamt werden 2 Elektronen für ein Mol H2 benötigt. Bei Zn und Cu, liegen die beiden als Cu^2+ oder Zn^2+ vor und ein Ion nimmt zwei Ladungsträger auf. Bei all diesen Reaktionen werden also insgesamt immer zwei Ladungsträger benötigt/frei, sodass mit der gleichen Ladung wie zuvor beim Silber, jetzt nur noch die Hälfte der Stoffmenge elektrolysiert/erhalten werden kann.
Chlorid (Cl^-) müsste dann ja eine positive Ladung aufnehmen um Chlor zu bilden, Chlor liegt molekular vor. Also zwei Chlorid-Ionen nehmen 2 positive Ladungen auf, um ein Molekül Chlor (Cl^-) zu bilden. Bei Sauerstoff dann logischerweise 2 und weil O2 vorliegt insgesamt vier und dadurch nur noch ein Viertel. (Je nachdem wie du es dann betrachtest, geben die negativ geladenen Teilchen auch einfach die negative Ladung ab.
Also halten wir weiterhin fest: Bei unterschiedlich geladenen Ionen, die die gleiche Menge an Elektrizität/Ladung erfahren, ist die Stoffmenge die reduziert durch die Ladungszahl des Ions bestimmt und das in umgekehrt proportional. Und das ist dann das zweite Faraday'sche Gesetz.