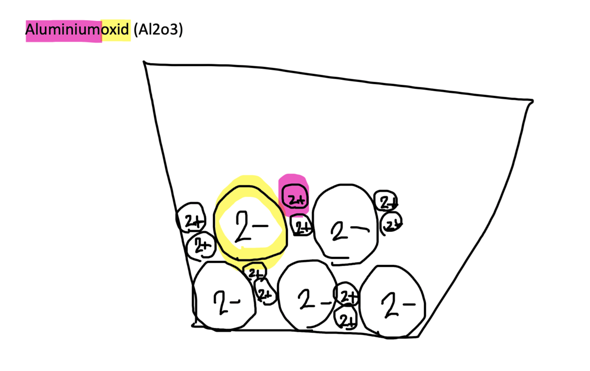
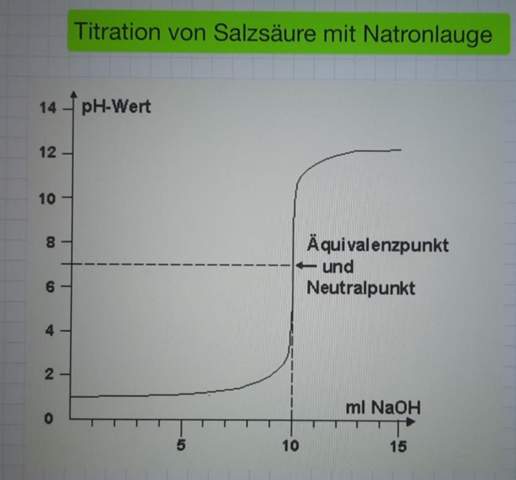
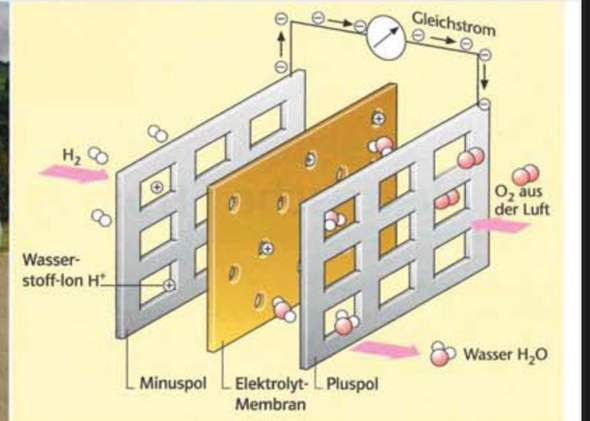
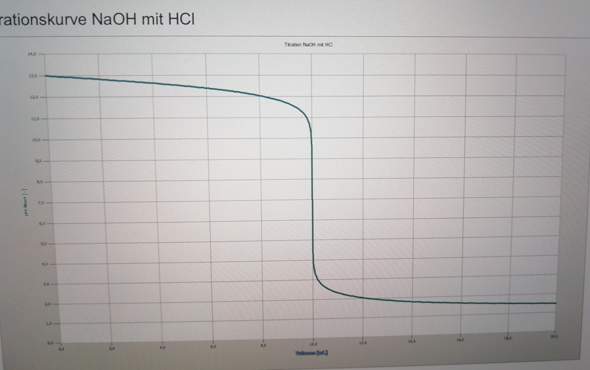
Wasser wird erhitzt und wird zu Wasserdampf. Wenn es abkühlt dachte ich es wird zu 100 Prozent wieder Wasser.
Aber folgendes Experiment widerspricht meiner Vorstellung:
In einem mit Wasser gefüllten Kochtopf habe ich ein Wasserglas kopfüber platziert. Das Glas im Topf ist komplett mit Wasser ausgefüllt und beinhaltet absolut keine Luft mehr.
Kochtopf wird erhitzt und das Wasser kocht. Es bildet sich eine Gasblase im Wasserglas (Wasserdampf). Der Kochtopf kühlt ab und diese Gasblase ist im abgekühlten Zustand viel größer geworden.
Welches Gas hat sich im Wasserglas gebildet? Warum bildet sich der Wasserdampf nicht komplett nach dem Abkühlen zu Wasser zurück?