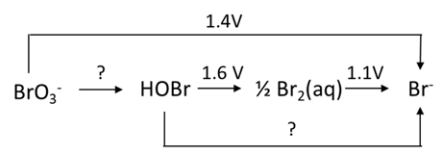
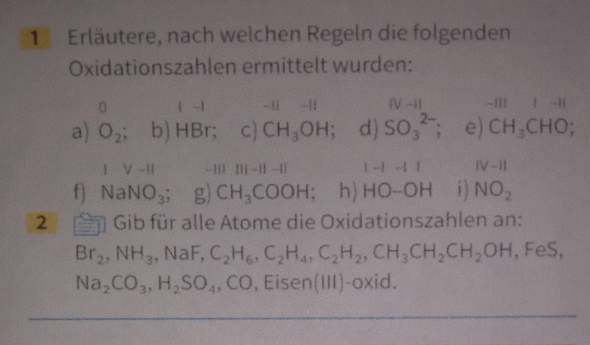
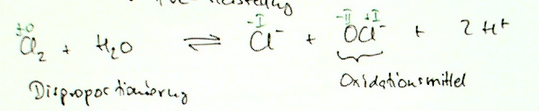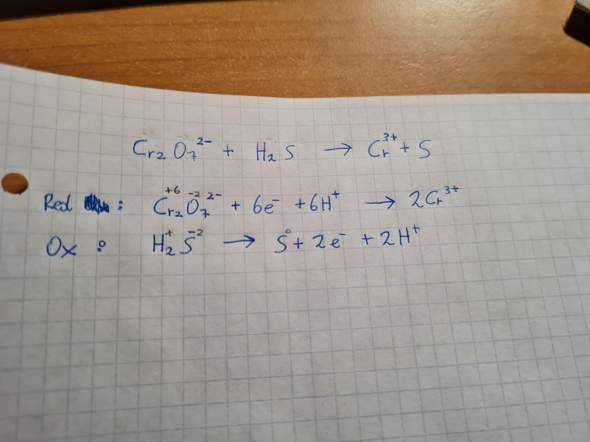Dies hier wird eine kleine Diskussion im Bereich der Sprachkunde und Sprachphilosophie bezüglich der Identität der Sprache (also: Was ist Sprache) und der Entwicklung der Sprache (Wie und warum verändert sich Sprache). Denn ich habe Theorie entwickelt, die mir sehr nützlich und valide erscheint, die dieses beschreibt und erklärt. Aber ich erwarte nicht, dass diese einfach so oder widerstandslos akzeptiert wird, sondern eher, dass es in einer klischeehaften Platon vs. Aristoteles Debatte münden könnte (oder anderweitiger Universalienstreit), weswegen ich das hier als Diskussion eröffne. Wie auch immer sich das entwickeln soll. Könnt natürlich auch Zuspruch geben.
Meine These ist: Sprache an sich ‚existiert nicht‘. Das, was wir als eine Sprache (oder gar ein Soziolekt, Dialekt, etc.) bezeichnen, ist in Wahrheit lediglich eine mentale Abstraktion von vielen Idiolekten. Jedes Individuum hat seine Individualsprache (Idiolekt), die in der Kommunikation mit anderen creolisiert. Die Kreolsprache aller Idiolekte ist die letztendliche SPRACHE (TM).
(Beispiel: Deutsch ist kein Ding. Sondern Deutsch ist die Summe aller Wörter, Laute und Strukturen, die deutsche Leute verwenden und verwendet haben. Jeder spricht sein eigenes Deutsch. Die Analyse aller Ähnlichkeiten ergibt ein gemitteltes Deutsch, eine Abstraktion.)
Wir sehen, dass sich Sprache über die Zeit verändert. Ich schreibe dies dem Spracherwerb selbst zu, aber auch anderen Faktoren. Es gibt genau drei Gründe, warum sich die eigene Sprache, der eigene Idiolekt verändert: 1. Ideologie, 2. Imitation und Einfluss, 3. Wenn Fehler und Abweichungen bei zweiteren passieren, die in der Regel unbewusst sind.
Ideologie bezieht sich darauf, dass jemand aktiv und bewusst die Art seines Ausdrucks verändert. Er übt Phonetik, einen Stil, erfindet eigene Sprachen und setzt eigene Grammatik durch, die er extra anlernt.
Wir wissen außerdem, dass der Mensch durch Imitation lernt. Wir werden durch die Art anderer Leute beeinflusst (meist unbewusst). Man sagt nicht ohne Grund: "Erzähl mir, mit wem du gehst, und ich sage dir, wer du bist". Gleichzeitig wissen wir, dass Muttersprachler die Sprache ihres Umfeld lernen, nicht irgendeine andere, und auch den Dialekt zu Hause, und auch den Soziolekt ihres Freundeskreises, etc. Sobald man mit einer Person kommuniziert, beeinflusst man sie mit dem eigenen Idiolekt (und umgekehrt).
Zudem geschehen durch kleinere Zufälligkeiten gewisse Nuancen in Sprech und Ausdrucksweise. Man eignet sich keine perfekte Kopie der Außenwelt an, sondern macht Fehler und Abweichungen. Vielleicht entwickelt jemand einen Akzent. Jemand anderes kann aus gewissen motorischen oder psychologischen Gründen nur in gewisser Weise klingen und betonen. Der andere lässt gewisse Grammatiken aus, oder fügt sie hinzu. Etc. Doch jemand, der diese Fehler macht, bringt sie jedem, mit dem er spricht, ein kleines bisschen bei. Das ist auch meine nächste These: Kommunikation führt zum Konvergieren, Distanzieren (Nicht-Kommunizieren) zu Divergieren der Sprachen. Denn, wer nicht miteinander spricht, beeinflusst sich nicht mehr und kann die eigenen "Fehler" nicht mehr annähern und korrigieren. (Und wir erinnern uns von oben, dass jedes Individuum seine eigene Sprache hat.)
Wie kann man das verdeutlichen, oder begründen? Ich will dazu ein Gedankenexperiment machen. Angenommen, ein Engländer und ein Chinese finden sich auf einer immer-einsamen Inseln zu zweit wieder. Der Argumentation wegen, geben wir beiden das ewige Leben, aber sie haben keinerlei Erfahrung in der Sprache des Anderen. Wir nehmen auch an, dass beide an Kommunikation interessiert sind. Was passiert? Nun, sie könnten einfach gemeinsam eine neue Sprache erfinden. Indem der Engländer auf einen Baum zeigt und eine wahllose Abfolge von Silben spricht, wird ein gemeinsames Symbol erschaffen. Dieses würden wir in den Bereich des ideologischen Sprachwandels auffassen, da er aktiv und bewusst ist. (Selbst meinetwegen unter Bow Wow Theorie etc. Gegebenheiten).
Gehen wir davon aus, dass beide ihre eigene Sprache zueinander sprechen. Dann, nach dem Gesetz der Imitation (oder auch schlichter Comprehensible Input) wird der Chinese den Engländer und der Engländer den Chinesen seine eigene Sprache anlehren. Sie beeinflussen sich gegenseitig. Auf lange Sicht werden sich die Sprachen also vermischen, und sie bilden eine Kreolsprache, ein sogenanntes Anglo-Chinesisch vielleicht. Natürlich können die beiden Sprachen unterschiedlich dominant sein. Aber trotzdem können wir des Weiteren festhalten, dass die Geschwindigkeit dieser Prozesse von der Kommunikation der beiden Parteien abhängt.
Ich habe nicht mehr viele Zeichen übrig, deswegen halte ich es kurz. Wenn zwei Kreise von Leuten natürlich nicht miteinander sprechen, dann divergieren sie, da in jedem dieser Gruppen andere Fehler geschehen, die sich dann wie bei einer Epidemie in der gesamten Gruppe verbreiten. Aber eben nicht weiter. Deswegen gibt es verschiedene Sprachen.
Hier noch eine Darstellung: