Oxidation von Cr2O7^2- zu 2Cr^3+ Was mache ich nur falsch ?
Hallo Chemiker unter euch,
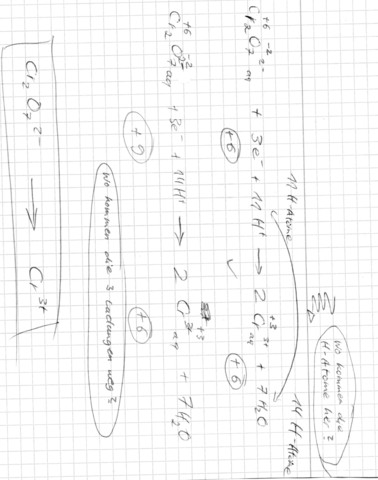
ich soll nach dem Schema im Anhang die Oxidation von Cr2O7^2- zu 2Cr^3+ bearbeiten.
Beim 1. Versuch sind auf der rechten Seite mehr H-Atome als auf der linken Seite, beim 2. versuch sind die Ladungen auf beiden Seiten anders.
Würde mich sehr freuen, wenn mir jemand dabei helfen könnte.
carbonpilot01

1 Antwort
Von Dichromat Cr₂O₇²⁻ zu Cr³⁺ ist es eine Reduktion, keine Oxidation. Denn die Oxidationszahl sinkt ja von +VI auf +III.
Da kein Reaktionspartner fürs Dichromat gegeben ist, kann man nur eine Halbgleichung aufstellen. Dazu schreiben wir mal das Skelett auf. Pro Chrom werden drei Elektronen umgesetzt (aus den Oxidationszahlen ersichtlich)
Cr₂O₇²⁻ + 6 e⁻ ⟶ 2 Cr³⁺
Jetzt müssen wir nur noch die Sauerstoffe verräumen. Dichromat arbeitet am besten in sauerer Lösung, also nehmen wir H₃O⁺ und setzen die 7 O-Atome zu Wasser um:
Cr₂O₇²⁻ + 14 H₃O⁺ + 6 e⁻ ⟶ 2 Cr³⁺ + 21 H₂O
Das müßte jetzt wohl reichen.
Und 2.): Stimmt meine Redoxgleichung: (Cr2O7)^2- + 3C2H5OH --> 2Cr^3+ 7H2O + 3CH3CHO
Wo sind denn da die H₃O⁺? Man sieht ja gleich, daß die Ladungen links (2−) und rechts (6+) nicht übereinstimmen, also muß die Gleichung flasch sein.
Die professionelle Variante wäre es, mit einer Halbgleichung für die Ethanol/Ethanal-Oxidation zu beginnen (zwei Elektronen Umsatz pro Aldehyd), und die dann zur von mir gelieferten Halbgleichung dazuzuaddieren.
Vielen, vielen Dank! Das hat mir sehr geholfen :-). Dass es eine Reduktion ist, wusste ich selbst, ein Fehler meiner Hastigkeit. Ich hab verpeilt, dass 6 Elektronen auf der linken Seite dazukommen, ich habe nur für ein Chrom gerechnet und bin so auf 3 Elektronen gekommen. Dann habe ich aber noch eine Frage: Ich habe anstatt mit Oxoniumionen mit Wasserstoffionen gearbeitet, sodass ich als Edukt nur 7 Wassermoleküle stehen habe. Das ist dann aber auch richtig, oder?
Auf der linken Seite sollen noch 8H+ stehen, die habe ich vergessen ;D