Wo fand eine Oxidation und eine Reduktion statt (Chemie)?
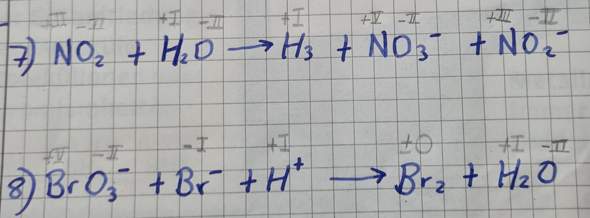
Ich weiß ja dass Oxidation=Elektronenabgabe und Reduktion=Elektronenaufnahme ist, aber ich kann trotzdem nicht zuordnen wo es ist
Ah ja und bei 7) No2 hat N eine OZ von +4 fällt mir auf
Überprüfe deine Reaktionsschemata. Die stimmen nicht! Was ist zum Beispiel H3??
oops ja H3 müsst ja +-0 sein... Ist das meine einzige falsche Oxidationszahl?
1 Antwort
Nr 7 ist eine Disproportionierung d.h. dass NO2 einmal zu NO3- oxidiert wird und einmal zu NO2- reduziert wird.
Nr 8 ist eine Synproportionierung d.h. dass Br- zu Br2 oxidiert wird und BrO3- zu Br2 reduziert wird.
7 O:
NO2 + H2O → NO3- + 2H+ + e-
R:
NO2 + e- → NO2-
8O:
10Br- → 5Br2 + 10e-
R:
2BrO3- + 12H+ + 10e- → Br2 + 6H2O (schon ausgeglichen)