Good evening in the evening
wir fangen direkt mit dem Stoff an.
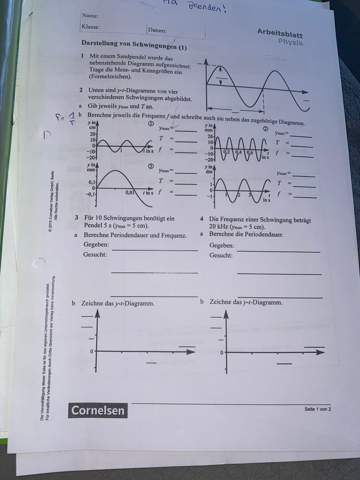
ier Mol eines idealen Gases werden von dem Volumen V1 auf das Volumen V2 = 2 V1 entspannt.
(a) Wie groß ist die Arbeit, die das Gas bei isothermer Expansion (T = 400 K) leistet und wie groß ist dabei die Anderung der inneren Energie des Gases?
(b) Wieviel ändert sich dabei die Entropie, wenn uberhaupt?
(c) Falls die Expansion adiabatisch reversibel und nicht isotherm verliefe, wurde die Entropieänderung positiv, negativ oder gleich null sein?
Jensek81'scher Ansatz
W = -nRT ln (V2/V1).
Da hätten wir dann aber das Problem'sche, dass wenn man die Werte einsezt
-4 * 8,3145 * 400 K * ln (2) = -9221
eine negative Zahl rauskommt.
Und das ist nicht schön.
b) Da bei isothermen Prozessen die Temperatur konstant bleibt : Q = W
=> Entropieänderung: -nR (ln(2). / T => -4 * 8,3145 ln (2) / 4000 = - 5,76 * 10^-3
Dersselbe Oschi. Käme wieder ne negative Zahlr aus
c) Da keine ärme mit der Umgebung ausgetauscht = Null.
Mit freundlichen Grüßen,
Steffen Baldrian.