Störungstheoretische behandlung der chemischen reaktivität und andere Dinge?
Hallo zusammen,
Als erstes möchte ich sagen, dass das hier nicht grosskotzig rüberkommen soll und nicht überheblich gemeint ist.
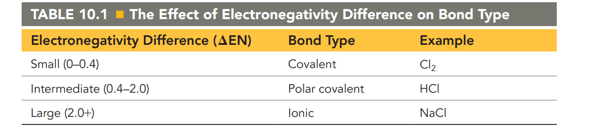
In letzter Zeit habe ich folgendes Problem. Ich mache eine chemieausbildung und bin im Vergleich zum Rest der Klasse oder dem Unterricht eher etwas vorraus. Bei vielen sitzen jetzt auch nach zwei Jahren die grundkenntnisse wie Elektronegativität Redox und allgemeines Fachrechnen noch überhaubtnicht, was mich oft wütend macht. Ich habe das gefühl dadurch mein wissen seit etwa einem Jahr nicht wirklich erweitert zu haben. Im Unterricht wird ständig wiederholt und nichts neues kommt dazu.
Ich habe im selbststudium nun gelernt wie man organische grossmoleküle nach IUPAC benennt und bin relativ tief ins Fachrechnen eingetaucht. Die unterlagen habe ich von einem freund der Familie bekommen der Lange chemie studiert hat.
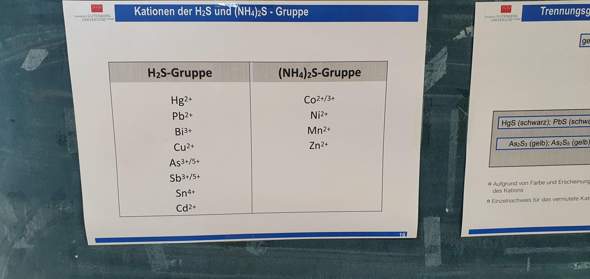
Jetzt möchte ich lernen mit der FMO Theorie und änlichem umzigehen. Aber hier stosse ich ehrlich gesagt an meine grenzen. Ich finde nur wenige unterlsgen dazu und habe wenig kontext und bezug auf das was vorhanden ist. Das gleiche Problem hatte ich auch schon bei der quantitatieven Behandling von polaren Sub. Effekten. Bei dem verstehen und herleiten der Hammet gleichung wurde es dan schon schwierig.
Meine eigentliche Frage ist wo muss ich anfangen. Was muss ich verstehen. Soll ich überhaupt weiter machen, weil momentan stehe ich völlig auf dem Schlauch. Gibt es Bücher die ich mir zu Hilfe holen kann?
Ich hoffe man versteht einigermassen wo mein Problem ist. Ich wäre sehr dankbar für Tipps von jemanden der sich mit diesen Dingen auskennt.