Bildungsmechanismus von Cumen (2-Propylbenzol) zu Hydroperoxides?
Hallo gemeinsam!
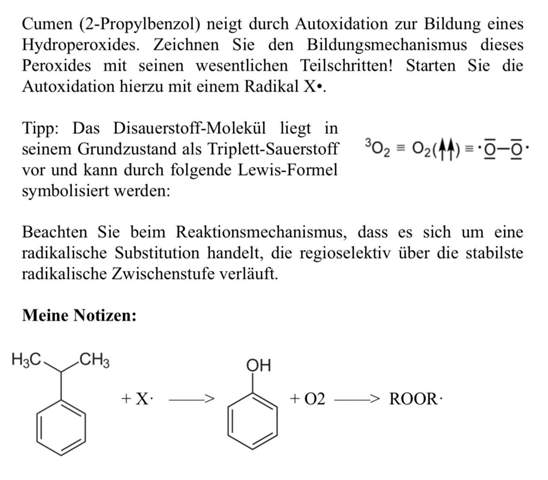
Es geht um die organische Chemie, mit der ich leider richtige Schwierigkeiten habe.. dazu gibt es diese Aufgabe, bei der eine Autooxidation stattfindet und der Bildungsmechanismus angefertigt werden soll. Jedoch weiß ich nicht womit ich beginne und wie ich diese weiterführen sollte. In meinen Notizen gibt es garantiert Fehler, also wäre es sehr sehr nett und hilfreich, wenn sich jemand bereit erklärt mir diese zu erklären bzw mir einen Denkanstoß zu geben. Ich hätte es aus dem Internet abschreiben können, jedoch will ich es verstehen, vor allem bezogen auf meinem Studium :( Ich wäre euch für jede kleine Antwort und Hilfe dankbar!
4 Antworten
MMn ist es ziemlicher Quatsch als Anfänger zu glauben, man könne 'mal eben' einen 'neuen und unbekannten' Mechanismus 'entwickeln'. Die klügsten Köpfe haben sich an sowas Jahrzehnte die Zähne ausgebissen und wenn sie es rausbekommen haben, haben sie einen NobelPreis bekommen!
Die meisten lernen einfach die StandardMechanismen auswendig. Und später reicht das richtige 'Stichwort' und sie können ihn auch auf neue Systeme anwenden. Dafür ist es nicht wichtig, auf jeden einzelnen Schritt 'von selbst' gekommen zu sein, aber man kann natl. die entscheidenden Schritte begründen.
Ich danke Ihnen für die Antwort.. ja wie gesagt, bin nicht die beste darin und musste mich mit dieser Aufgabe rumschlagen. Aber welche Standardmechanismen können Sie vorschlagen, die man auswendig lernen kann und dann anwenden kann?
Du weißt vermutlich, daß die Stabilität von Radikalen nach primär < sekundär < tertiär zunimmt. Zusätzliche Phenolringe stabilisieren ganz erheblich, so daß das Benzylradikal C₆H₅–ĊH₂ mindestens so stabil ist wie ein aliphatisches tertiäres Radikal, obwohl es formal primär ist; das liegt daran, daß das ungepaarte Elektron auch über drei Ringatome delokalisiert werden kann.
Daraus folgt, daß ein Radikal C₆H₅–Ċ(CH₃)₂ noch wesentlich stabiler als ein typisches tertiäres Radikal sein sollte, und das macht es zu einem guten und plausiblen Intermediat in der Reaktion. Wir können also vermuten, daß ein Schritt der Reaktion ungefähr so aussehen wird wie
C₆H₅–Ċ(CH₃)₂ + O₂ ⟶ C₆H₅–C(CH₃)₂OO⋅
und das dabei gebildete Peroxid-Radikal klaut sich beim nächsten Cumen-Molekül ein H, so daß dabei einerseits das Endprodukt Cumenhydroperoxid entsteht und andererseits wieder ein neues Cumen-Radikal, das mit einem neuen Sauerstoff-Molekül wieder die Reaktion oben eingehen kann:
C₆H₅–C(CH₃)₂OO⋅ + C₆H₅H(CH₃)₂ ⟶ C₆H₅–C(CH₃)₂OOH + C₆H₅–Ċ(CH₃)₂
Diese beiden Schritte konstituieren die Radikalkette; sie laufen immer wieder abwechselnd ab und erzeugen in jedem Cyclus ein neues Produktmolekül. Da ist also das Herz des Reaktionsmechanismus.
Es stellt sich aber noch die Frage, wie die Reaktion eigentlich beginnt, wie also die ersten Moleküle Cumen-Radikal überhaupt gebildet werden. Dazu muß irgendjemand einem Cumen-Molekül ein H wegreißen, und dieser Jemand muß ziemlich sicher selbst ein Radikal sein. Dabei gibt es zwei Möglichkeiten:
- Entweder fügt man einen Starter hinzu, das ist ein Molekül R–R mit einer schwachen Bindung in der Mitte, so daß das Molekül leicht in zwei Hälften zerbricht: R–R ⟶ R⋅ + ⋅R; jedes der beiden Radikale R⋅ greift dann ein Cumen-Molekül an und klaut ihm das H. Es entstehen also letztlich pro Starter-Molekül zwei Cumen-Radikale C₆H₅–Ċ(CH₃)₂, die dann die oben beschriebene Radikalkettenreaktion eingehen.
- Allerdings kann Sauerstoff O₂ selbst auch als Radikal wirken, weil es einen Triplett-Grundzustand (3Σg-) hat; in diesem Fall spricht man auch von Autoxidation. Dabei reagiert der Sauerstoff (mit mäßiger Effizienz) direkt mit dem Cumen zu einem Hydroperoxid-Radikal HOO⋅, und es entsteht wieder ein Cumen-Radikal, das anschließend die oben beschriebene Kettenreaktion eingeht
C₆H₅–CH(CH₃)₂ + O₂ ⟶ C₆H₅–Ċ(CH₃)₂ + HOO⋅
Die Kettenreaktion erzeugt immer aus einem Radikal C₆H₅–Ċ(CH₃)₂ ein neues Radikal C₆H₅–C(CH₃)₂OO⋅ und umgekehrt. Die absolute Konzentration an Radikalen ist dabei gering, aber mit etwas Pech stoßen auch mal diese beiden Radikale zusammen und reagieren glatt zu Dicumylperoxid:
C₆H₅–C(CH₃)₂OO⋅ + C₆H₅–Ċ(CH₃)₂ ⟶ C₆H₅–C(CH₃)₂–OO–C(CH₃)₂–C₆H₅
Dabei gehen die Radikale verloren, also bricht die Kette ab. Es gibt noch viele weitere mögliche Abbruchsreaktionen (sogar mit der Gefäßwand!), und eine andere liefert 1,1,2,2-Tetramethyl-1,2-diphenylethan; Du kannst Dir selber überlegen, wie das zustande kommen könnte.
Warnung: Ich habe mir das gerade aus dem Finger gesaugt und nicht großartig nachgeprüft, vielleicht stimmen ein paar Details nicht.
Alkoxyradikal? Meinst Du so etwas wie C₆H₅–C(CH₃)₂O⋅? Wo soll denn das herkommen?
Vereinfacht gesagt, doch Abstrahierung/Abspaltung eines OH Radikals, wenn ein Edukt und ein ROOH miteinander reagieren.
Die Punkte stehen fürs radikalische Elektron; ich setze sie rechts vom Elementsymbol, wenn es am Ende der Formel steht, oder darüber, wenn es irgendwo in der Mitte steht.
2-Propylbenzol ist kein valider Name für Cumen.
Radikalabbruch tritt auf, wenn zwei Radikale miteinander zu einem Teilchen mit gerader Elektronenanzahl reagieren. Aber ich verstehe nicht wirklich, was Du fragst.
Danke! Sie haben meine Frage beantwortet und die Aufgabe ist mir auch leichter eingefallen!
Ich danke dir für diese sehr sehr ausführliche Erklärung und Darstellung! Mit deiner Hilfe konnte ich jetzt einiges zusammenfassen bzw meine Notizen verbessern/ vereinfachen.
Jedoch hätte ich eine Frage, wie läuft denn ein Kettenabbruch ab? Was würde im Falle von 2-Propylbenzol geschehen? Ich hätte darauf getippt, dasss man O2 zusätzlich hinzufügt, um diese Verbindung zu instabilsieren? Oder macht es keinen Sinn :(
P.S.: Cumen ist nicht 2-Propylbenzol (dann wäre ja 2 die Position am Benzolring), sondern es muß Isopropylbenzol oder (Propan-2-yl)benzol heißen.
Überleg mal, warum vielleicht das Wasserstoffatom am tertiären C-Atom, sehr dazu neigt radikalische Reaktionen einzugehen.
Danke für die Antwort! Ich denke mal weil der Wasserstoff, welcher an de Kohlenstoffatom festgebunden ist, einfacher abgespalten wird? Und das hängt mit der Stabilität der Kohlenstoffatome? Sonst wüsste ich nicht, wie ich die frage beantworten sollte, zumal meine Vermutung auch garantiert falsch sein kann..
Die Idee stimmt schon, das Radikal, dass dort gebildet wird, ist am stabilsten. Im nächsten Schritt bildet sich dort das Peroxid.
Der Name 2-Propylbenzol ist schon mal falsch. Am Benzol gibt es nämlich keine 2-Stellung, weil es keinen Substituenten in 1-Stellung gibt.
Da ist ein kleiner Schönheitsfehler drinnen:
Das Peroxy-Radikal reagiert später mit einem Alkoxyredikal und mehr Sauerstoff. Dabei entstehen zwei Produkte, einmal der Alkohol und einmal das Aldehyd bzw Keton. Das ganze läuft auch über den ROOH Zwischenschritt ab, der dann mit ROO´ reagiert. Dabei entsteht m.E. einmal das Hydroperoxy und ein neues Radikal. Von diesem erfolgt eine Abspaltung eines OH-Radikals. Der Rest ist trivial bzw schon korrekt erkannt.