Hallo Leute,
Ich hätte 5 fragen zu Chemie:
1)
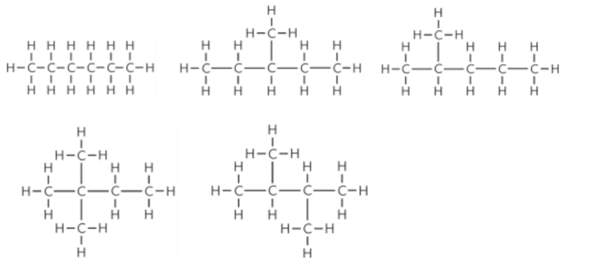
Stoffe kann man ja in Reinstoffe und Stoffgemische einteilen.
Reinstoffe dann wieder in chem. Elemente und chem. Verbindungen.
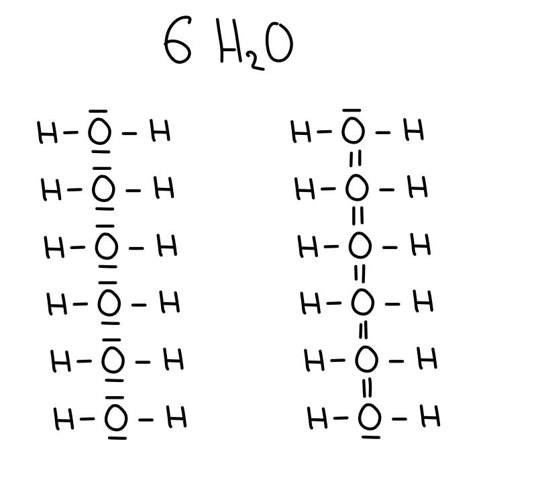
sind Elementmoleküle jetzt Elemente oder Verbindungen, weil es sind ja Moleküle aber nur aus einem Element. Oder zählen zu den Elementen nur die Metalle, weil die nichtmetalle ja alle Moleküle bilden, wobei ich mir dabei auch nicht sicher bin, was mich zur nächsten Frage führt.
2)
bilden alle Elemente der Nichtmetalle Moleküle? Oder gibt es in der Natur auch Elementare Nichtmetalle? Als Beispiel, das Element Chlor (Cl) liegt ja in der Natur nur als Elementmolekül (Cl2) vor, ist das bei Allen Elementen der nichtmetallen so?
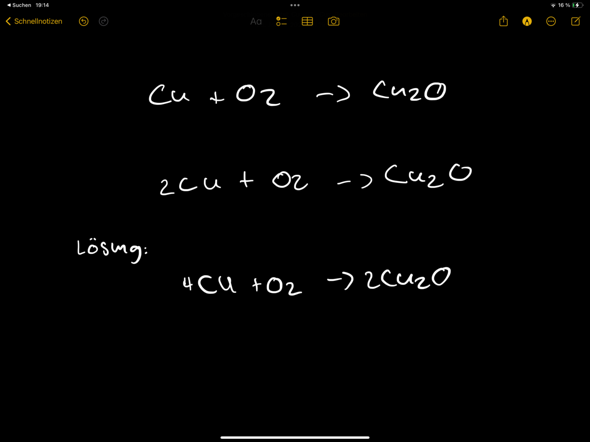
denn ich war im Chemieunterricht sehr verwirrt, weil ich nicht wusste, ob Schwefel als Element oder als Molekül vorkommt weil weder im Periodensystem noch in unserem Tafelwerk bei der Formel eine heruntergestellte Zahl steht (z.B. S2), welche ja ein Zeichen für Moleküle sind. Aber Schwefel ist ja ein Molekül, und deswegen wollte ich fragen, ob alle Elemente der 4. bis 8. Hauptgruppe (nichtmetalle) Moleküle bilden
3)
bilden Ionen immer Ionensubstanzen, also Ionenpaare? Oder gibt es auch Ionen, die in alleine vorkommen? Als Beispiel für meine Frage, gibt es das Chlorid ion nur als ion in ionenbindungen wie NaCl oder auch als reines Ion, weil es hat ja die edelgaskonfiguration.
4)
nur nochmal zum sichergehen, Metalle (1. bis 3. Hauptgruppe + Nebengeuppen) bilden ja logischer weiße alle Metalle und keine Moleküle, und Ionen bzw ionenbindungen können doch alle Elemte außer die der 4. und 8. Hauptgruppe bilden, oder?
5)
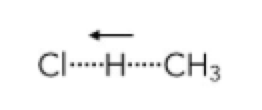
noch eine letzte Frage, wenn man das Chemische Zeichen für Chlor angeben soll, muss man dann das Symon (Cl) oder die Formel (Cl2) angeben?
schonmal Danke im Vorraus und Liebe Grüße,
Karl.