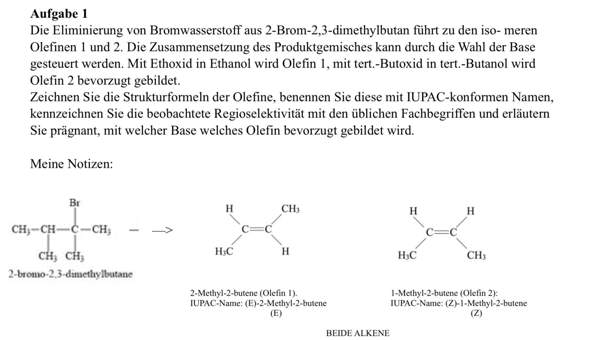
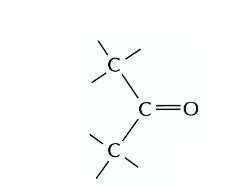
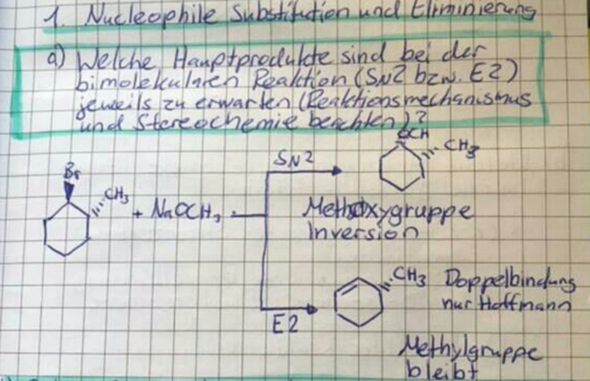
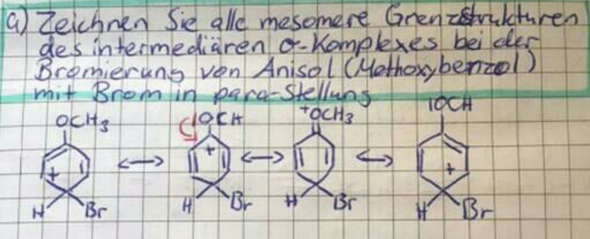
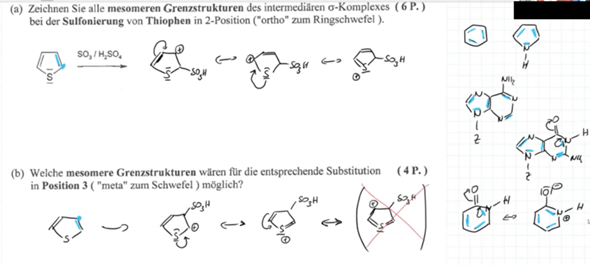
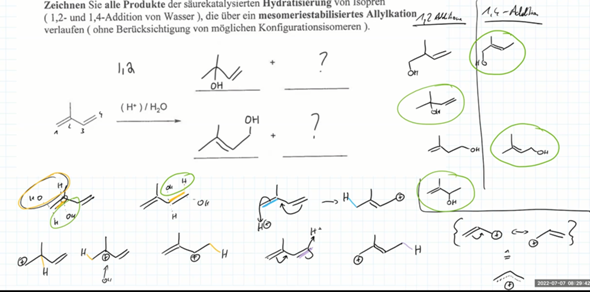
Wir verstehen gerade nicht warum bei folgender Eliminierung nur das Hoffmann-Produkt gebildet wird und das Saytzeff-Produkt peu a peu flöten geht.
Schon klar, das Brom verschwindet und das H am Kohlenstoff-Atom oben links klappt nach innen rein. Aber oben rechts, an dem C-Atom wo die Methylgruppe hängt, hängt doch eigentlich auch noch ein H. Das könnte man doch auch reinklappen, oder.
Frage 1: Warum geht das nicht?
Jetzt steht in der Lösung aber "Doppelbindung: nur Hoffmann"
Etwas weiter unten folgt dann die Auflösung:
Hääää? Das versteh' ich überhaupt nicht. Wir haben in der Vorlesung gelernt: "Bei Eliminierungen gilt die Hofmann-Regeln: Die Eliminierung findet so statt, dass die DOppelbindung immer Z-konfiguriert ist"
Z heißt ja, dass die Striche zu den C-Atomen [also die Substituenten] die an der Doppelbindung hängen, in diesselbe Richtung zeigen (Z = Zusammen).
Jetzt steht hier: "E2 erfordert "antiperiplanare" trans-Stellung von H / Br". Häää? trans heißt doch entgegen und entgegen heißt E-konfiguriert. Der widerspricht sich doch die ganze Zeit selbst🥴
Frage 2: Also ich habe jetzt aus der Diskussion mitnehmen können, daß Eliminierung immer so stattfindet, daß die Doppelbindung Z-konfiguriert ist. Gleichzeitig darf ich hier bei dieser Aufgabe nur das Hoffmann-Produkt bilden, weil die Eliminierung eine E-Konfiguration von H und Br erfordert. Stimm das so?
So, jetzt hatten wir aber auch mal eine andere Übungsaufgabe gehabt, wo man eine Eliminierung von Chlor durchführen muss bei Ethanolamin (2-Aminoehanlol). Da kam dann folgendes raus
Hääää? Da ist geht jetzt auf einmal wieder das Saytzeff-Produkt. Obwohl wir doch gerade gelrnt haben, daß bei Elimierung immer die Hoffmann-Regel gilt und die Doppelbindung Z-konfiguriert ist. Aber hier haben wir ja das Saytzeff-Produkt und das ist jetzt E-konfiguriert.
Wir sind jetzt alle total verwirrt, ob es jetzt wirklich so ist wie in der oberen Aufgabe, also dass man nur das Z-konfigurierte Hoffmann-Produkt nehmen soll oder auch das E-konfigurierte Saytzeff.
Frage 3:Warum nimmt man oben nur Hoffmann und unten Hoffmann und Satyzeff?
Kann da bitte jemand kurz Licht ins Dunkeln bringen?
Danke und einen schönen sonnigen Dienstagnachmittag