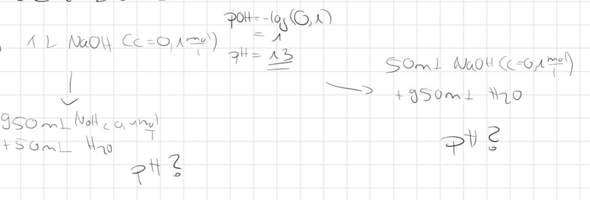OH- Konzentration aus pH wert?
Also da ich solangsam verzweifel und es auf Google scheinbar keinerlei passende Antworten gibt (warum auch immer immerhin kann man sich nicht klarer ausdrücken!) Außer einer kostenpflichtigen Seite, muss ich leider hier nachfragen!
Wie bereits in der Frage steht, muss ich aus dem pH die OH- Konzentration berechnen! Wir haben Calciumhydroxid in 100ml demin. Gelöst, die Flüssigkeit abfiltriert dann mit Vollpipette 20ml entnommen aus der Flüssigkeit, auf 100ml mit demin. Wasser aufgefüllt und dann mit 5 Tropfen Neutralroth Indikatorlösung rein.
Anschließend haben wir mit einer 0,1 M HCl Säure titriert.
Die Aufgaben dazu sind
1. Ermitteln sie die OH- konz. Aus dem Salzsäure Verbrauch!
Da ich nicht wirklich sicher bin in Chemie und dieses Fach zutiefst verabscheue, habe ich vermutet (siehe Bild) und es so ausgerechnet! Keine Ahnung ob das auch nur ansatzweise stimmen kann!
Die 2 Aufgabe macht mich nun aber richtig fertig, da wir sowas auch nie besprochen haben! Wir sollen wir gesagt aus dem gemessenen oh wert (12,3 bei 21,9°C) die OH- Konz. berechnen! Kann mir hierbei jemand helfen?
Und 3. Sollen wir die OH- Konzentration aus den Löslichkeit Produkte von Calciumhydroxid berechnen
Oder ganz genau steht dran: berechnen sie aus den OH- Konzentration jeweils das Löslichkeits Produkt von Calciumhydroxid.
Wieso jeweils? Wie?
Falls mir irgendjemand bei 2 helfen kann und zu 3 vielleicht einen kleinen Ansatz geben könnte wäre ich mehr als dankbar, da ich wirklich nicht die geringste Ahnung oder Idee mehr habe! Ich würde vermutlich das selbe wie bei 1. Machen!?