pH-Wert von Essigsäure-Natriumacetat-Puffer berechnen?
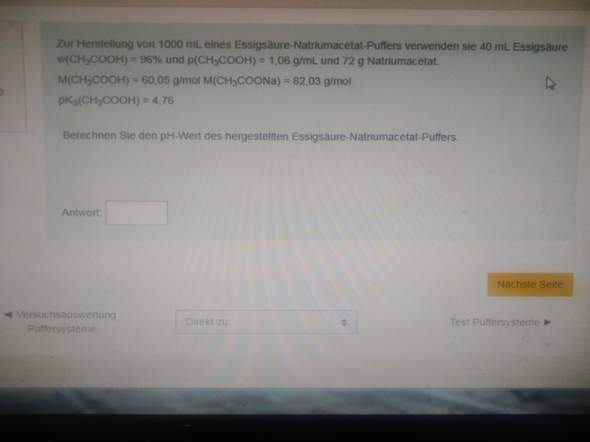
Hallo liebe Community, das oben ist die Aufgabe und das unten ist mein Rechenweg mit einem falschen Ergebnis

Ich bin am Verzweifeln und weiß echt nicht, was ich falsch mache. Über Antworten würde ich mich freuen.
1 Antwort
Die Stoffmengen n(Essigsäure) und n(Nariumacetat) sind von Dir richtig berechnet worden.
Nun musst Du aber c(Essigsäure) berechnen. Bedenke, dass die von Dir berechnete Stoffmenge n(Essigsäure) in V(Essigsäurelösung) = 40 mL = 0,04 L enthalten ist.
Der Nenner Deiner Henderson-Hasselbalch-Gleichung ist falsch.
Also: Nach c= n/V ist n = c · V
Ich erhalte pH ≈ 3,5
Ich kann deine Rechnung nachvollziehen, aber das Ergebnis ist leider pH=5,05
:(
Die Gleichung von Henderson-Hasselbalch wird in der Literatur mit Konzentrationen angegeben. Da aber V = const, kann man statt c hier n nehmen.
Ich bin beim Weiterrechnen davon ausgegangen, dass die gesamte Pufferlösung die gleiche Konzentration an Essigsäure haben soll wie die gegebene Lösung, und das ist falsch.
Also muss ich die 0,04 L auf 1 L bringen? Dementsprechend meine Stoffmenge von CH3COOH mal 25 nehmen?
Warum die c(Essigsäure) berechnen? Eigentlich brauchen wir doch nur die Stoffmengen...