Aufgaben zu pKs und pKb, pH-Wert Berechnung. Ich verstehe sie nicht?
Ich habe versucht folgende Aufgaben zu lösen, allerdings kommen Ergebnisse raus, welche unrealistisch sind. Es wäre sehr nett, wenn ihr mir bei diesen Aufgaben helfen könntet:
Geben Sie für eine einprotonige Säure mit pKs = 1,8 den Wert für Ks und Kc an.
Ks müsste ich ausgerechnet haben, nur wie komme ich jetzt auf Kc?
1g K2O wird in 100 mL H2O gelöst- Geben sie den pH-Wert der Lösung an.
K2O reagiert doch sofort zum KOH. Doch wie rechne ich die Konzentration von KOH aus? Ich hätte die Stoffmenge von K2O ausgerechnet und die von H2O und die beiden Stoffmengen ergeben dann die Stoffmenge vom KOH?
100 mL HCl mit einem pH-Wert von 0 werden mit 100 mL HCl mit einem pH-Wert von 1 gemischt. Geben sie den pH-Wert der entstanden Lösung an.
20 g Natriumacetat werden in 1 L H2O gelöst. pKB Acetat-Ion = 9,25.Berechnen Sie den pH-Wert.
In einer Natriumcarbonat-Lösung wird ein pH-Wert von 11 gemessen. Berechnen sie die Carbonat-Konzentration am Anfang.
Die Aufgaben sind keine Hausaufgabe, sondern ich verwende sie zum üben und würde mich über ein Ergebnis sehr freuen damit ich es verstehe. Meine Ansätze habe ich ja schon beschrieben.
1 Antwort
Machen wir das der Reihe nach und langsam.
Zuerst willst du die Säurekonstanten ineinander umrechnen. Eine Säure reagiert bekanntlich nach
HA + H₂O ⟶ H₃O⁺ + A⁻
und dafür schreibt man ganz gewöhnlich das Massenwirkungsgesetz an. Nun tritt darin aber c(H₂O) auf, und das ist lästig, weil es annähernd konstant ist (für reines Wasser ist ja c=ρ/M=55.4 mol/l). In verdünnter Lösung ist es nicht viel anders, und man zieht es daher bequemerweise zur Gleichgewichtskonstanten; die neue Konstante ist dann die Säurekonstante Kₐ=10⁻ᵖᴷᵃ.
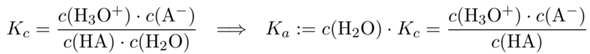
Damit sollte klar sein, wie Du das Beispiel lösen mußt: Kₐ=10⁻ᵖᴷᵃ=1.6⋅10⁻² mol/l und und Kc=Kₐ/c(H₂O)=2.9⋅10⁻⁴.
Als nächstes willst Du 1 g K₂O in 100 ml Wasser lösen. Das reagiert zu KOH:
K₂O + H₂O ⟶ 2 KOH
die Stoffmenge ist n=m/M=0.011 mol; daraus wird doppelt soviel soviel, also 0.021 mol, KOH, also hast Du eine Kalilauge der Konzentration c=n/V=0.21 mol/l, und der pH ist leicht zu berechnen als pH=14+lg(c)=12.33.
Jetzt willst Du zwei Salzsäuren unterschiedlicher Konzentration mischen, nämlich je 100 ml einer einmolaren und einer nullkommaeinmolaren Lösung. In Lösung 1 befinden sich n=c⋅V=0.1 mol HCl und in Lösung zwei 0.01 mol. Also haben wir am Ende 0.11 mol in 200 ml Wasser herumschwimmen, c=n/V=0.55 mol/l, und der pH berechnet sich zu pH=−lg(c)=0.26.
Der nächste Punkt ist eine Natriumacetat-Lösung der Massenkonzentrtion γ=20 g/l. Das rechnen wir als erstes auf Stoffmengenkonzentration um c=γ/M=0.24 mol/l. Dann müssen wir uns überlegen, daß das Acetat mit seinem pKb=9.25 eine schwache Base ist. Dazu gibt es eine Näherungsformel pH=14−½pKb+½lg(c), aber ich verwende immer die ungenäherte:
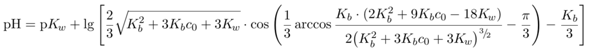
Jedenfalls kommt pH=9.07 heraus.
Der nächste Punkt ist etwas haariger. Wir haben eine Na₂CO₃-Lösung von pH=11 und wollen die Konzentration zurückrechnen. Dazu braucht man zunächst einmal eine Säure- bzw. Basenkonstante (die zweite Säurekonstante der Kohlensäure hat pKₐ=10.33, also pKb=14−pKₐ=3.67. Es liegt nun nahe, die oben von mir zitierte Formel für schwache Basen einfach nach c aufzulösen. Aber das wird relativ ungenau, weil das CO₃²⁻ keine ganz schwache Base mehr ist; Du würdest 0.004768 mol/l herausbekommen, die richtige Lösung ist aber c=0.005677 mol/l, und 18% des Carbonates haben darin zu Hydrogencarbonat reagiert:
CO₃²⁻ + H₂O ⟶ HCO₃⁻ + OH⁻
Wie Du das mit Schulmethoden hinkriegst, ist eine andere Sache. Für die Berechnung des pH-Wertes von Basenlösungen gibt es eine ganze Speisekarte von Formeln, je nach Dissoziationsgrad und pH.

Was Du machen müßtest: Du brauchst eine gültige Formel. Da die Dissoziation weder ≈100% noch ≈0% ist, muß das eine aus der letzten Zeile sein, am besten natürlich die linke, weil sie einfacher ist (die darf man verwenden, weil der pH weit von 7 entfernt ist, sonst ginge nur noch die rechte). Naja, und dann mußt Du sie eben nach c₀ auflösen, alles andere kennst Du ja (ich habe mein obiges Resultat übrigens numerisch berechnet, was ich darf, weil ich das Programm selbst geschrieben habe). Mit etwas Glück kommt dasselbe heraus.
Alle diese Formeln bekommt man übrigens mit Geduld & Spucke aus dem Massenwirkungsgesetz, indem man sich genau überlegt, was man wo wegnähert.
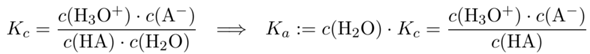
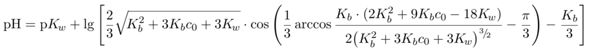

- Ich schreib Dir nur die gerundeten Werte in die Antwort, rechne aber natürlich mit ungerundeten. In diesem Fall ist M(K₂O)=94.196 g/mol, also ist ein Gramm eine Stoffmenge von m=1 g / M= 0.010616 mol (gerundet 0.011 mol), aber das Doppelte davon sind 0.0212323 mol bzw. gerundet 0.021 mol). Das ist also schon richtig so.
- pH=−lg(c) bzw. c=10⁻ᵖᴴ, weil es sich um eine starke Säure handelt, die in Wasser vollständig dissoziiert.
Kleine achbemerkung zur Carbonat-Aufgabe:
Die Konzentration einer Säure/Base aus dem pH rückzurechnen, ist generell keine sonderlich gute Idee (wäre es anders, dann würde kein Mensch titrieren, sondern einfach nur die Elektrode in die Lösung tauchen). Denn der pH hängt ja nur logarithmisch von der Konzentration ab, und 10 oder 20% mehr oder weniger von der Substanz schlagen sich nur in den Hundertstelstellen des pH nieder. Aus diesem Grund ist es auch kein großer Beinbruch, wenn man eine prinzipiell ungenaue Messung mit einer suboptimalen Formel auswertet.
Wenn Du die Carbonatkonzentration nach der simplen Formel pH=14−½pKb+½lg(c) aus dem pH ausrechnest, dann machst du damit zwar einen Fehler (wie ich gezeigt habe), aber die so berechneten 0.004768 mol/l hätten immerhin einen pH von 19.96 in Wasser (gerechnet mit der richtigen Formel), das ist normalerweise innerhalb der Meßungenauigkeit der pH-Elektrode. Also muß man da kein besonders schlechtes Gewissen haben.
Danke, aber ein pH-Wert von 19,96 gibt es doch nicht? Der pH-Wert ist doch von 0-14 definiert?
Tschuldige, die 9 und 0 liegen ja nebeneinander — es sollte 10.96 heißen.
Ok. Danke ! Und was meinen Sie mit der richtigen Formel? Das verstehe ich nicht so recht, können Sie das bitte nochmal ausführlich schreiben?
Die 0.004768 mol/l habe ich durch Umformen der simplen pH-Formel für schwache Basen, pH=14−½pKb+½lg(c), erhalten, indem ich pH=11 und pKb=3.67 eingesetzt und nach c aufgelöst habe. Wenn ich das c nun in dieselbe Formel nochmals einsetze, dann muß offenbar pH=11 rauskommen. Wenn man diese Konzentration aber in eine bessere pH-Formel rückeinsetzt (z.B. die mit den Winkelfunktionen) dann kommt eben nicht pH=11 raus, wie man erwarten würde, sondern nur 10.96 (was in der Praxis so gut wie dasselbe ist).
Der Unterschied zwischen den falschen 0.004768 und den richtigen 0.005677 mol/l ist zwar durchaus substanziell (20%), aber im pH schlägt es sich kaum nieder.
Vielen Dank für deine Arbeit!
Aber ist das doppelte von 0,011 mol, 0,022 mol und nicht 0,021 mol?
Und wie kommen Sie darauf, dass man eine 1 molare bzw. 0,1 molare HCl-Lösung vorliegen hat, wenn man nur die pH-Werte und das Volumen kennt?