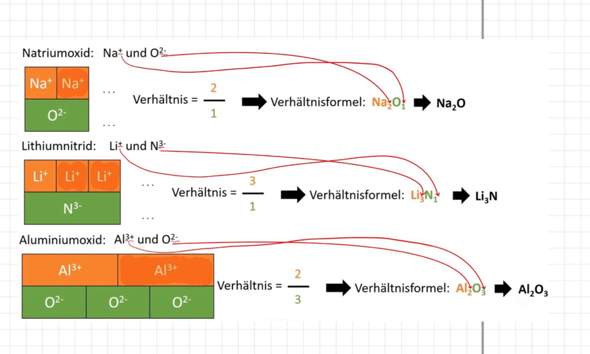
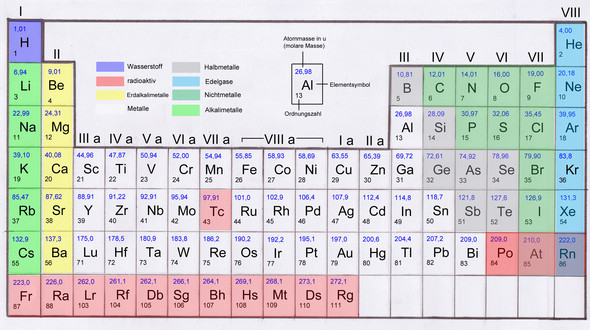
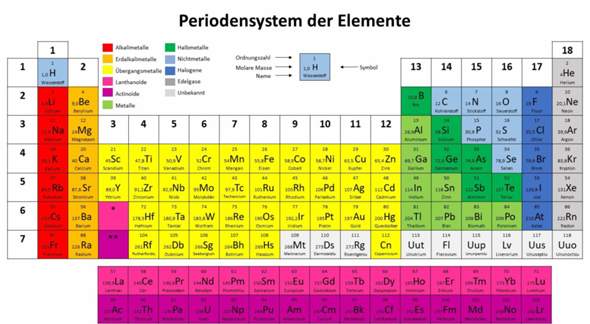
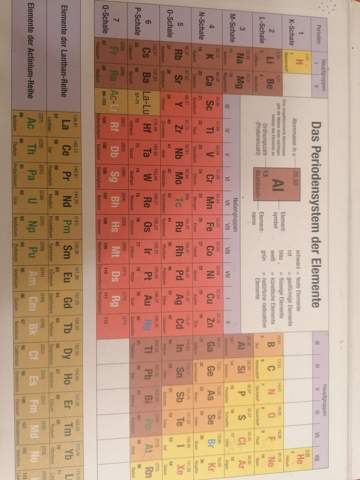
Kann mir jemand erklären, warum man bei Schwefel und Phosphor bei Atombindung bzw. kovalenten Bindungen manchmal sogar mehr als 4 Elektronenpaare haben kann?
Es geht um das Thema Atombindung. An der Stelle bin ich gerade im Lehrbuch.
Obwohl Phosphor in der 5. Hauptgruppe steht und somit maximal 3 Atombindungen eingehen müsste, um die Oktettregel zu erfüllen und Schwefel in der 6. Hauptgruppe 2 Atombindungen für die Oktettregel braucht, gehen beide Elemente mehr als die benötigte Anzahl an Bindungen ein.
///////////////////////////
Ich lerne gerade Biochemie aus einem Biochemie Buch für Medizinstudenten. Dieses Buch `` Biochemie des Menschen `` von Florian Horn wird an meiner Uni zum Lernen empfohlen.
DIE ERKLÄRUNG in diesem Buch ist folgende:
Kurz gesagt ... Es gibt mehr Möglichkeiten der Bindungsausbildung, weil Phosphor und Schwefel ihre aeusseren Elektronen wegen des großen Radius weil es große Atome sind schlechter festhalten koennen. Daher können manchmal mehr als 4 Elektronenpaare um das Zentralatom angebracht werden. Mehr steht da echt nicht drin.
Das mit den großen Atomen und größerem Radius verstehe ich, weil sie ja in der dritten Zeile im Periodensystem liegen und daher 3 Schalen haben, also ist der Radius größer.
/////////////////////
Ich versteh das so... Wegen des größeren Radius koennen Schwefel und Phosphor leichter mal Außenelektonen verlieren, weil sie nicht so stark vom Kern angezogen werden und dadurch kann es dann zu 4 Elektronenpaaren kommen anstatt 3 im Normalfall...
Das erklärt aber nicht, wie es sogar zu mehr als 4 Elektronenpaaren kommen kann.
---------------
Also die Erklärung in dem Buch ist einfach absolut undetailliert, daher zerbreche ich mir jetzt den Kopf.