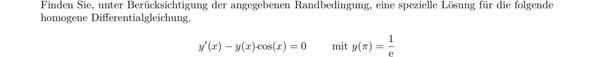Durch. Geschwindigkeit von Molekülen in Wasserstoffgas unerklärlich (Maxwell-Boltzmann-Verteilung)?
[Frage ist schon beantwortet, danke!]
Hallo,
in meinem Schulbuch steht, dass die Moleküle von Wasserstoffgas eine Geschwindigkeit von 1845 m/s bei 0 °C haben.
Das wollte ich online überprüfen und habe genau 1 PDF gefunden, in dem dieser Wert angegeben wurde.
Angeblich wurde dieser Wert mit der Formel c = sqrt(3*R*T/µ) berechnet, wobei
c die mittlere Geschwindigkeit in m/s, R die Gaskonstante, T die absolute Temperatur und µ die Masse eines Gramm-Moleküls ist.
Ein Gramm-Molekül ist nach meinem Verständnis dasselbe wie die molekulare Masse, die in g/mol angegeben wird.
Das bestätigt sich durch den Wikipedia-Artikel "Maxwell-Boltzmann-Verteilung", in dem sich dieselbe Formel findet, aber mit einem M anstatt einem µ.
Dennoch lässt sich der Wert 1845 m/s nicht durch die Formel berechnen:
Für R = 8,3; T = 273; M = 2 ist c = 58 m/s.
Mir ist auch klar, dass diese Formel das Quadratisches Mittel der Geschwindigkeit angibt (RMS speed) und nicht die durchschnittliche Geschwindigkeit,
aber dennoch sollte ich dem Wert 1845 m/s doch nahekommen.
Auf der Wikipedia-Seite findet sich ein Graph, auf dem Wasserstoffgas die häufigste Geschwindigkeit von etwa 1500 m/s besitzt, die der RMS Geschwindigkeit von 1845 m/s nahekommt.
Auf der Wikipedia-Seite ist ebenfalls die Formel der durch. Geschwindigkeit mit v = sqrt(8*R*T/(pi*M)) angegeben.
Rechne ich das mit denselben Werten wie vorher aus, komme ich auf 53 m/s. Ich scheine irgendetwas falsch zu machen, aber finde meinen Fehler nicht.