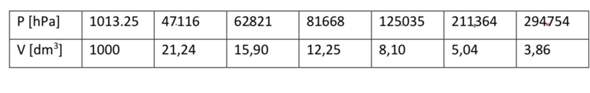
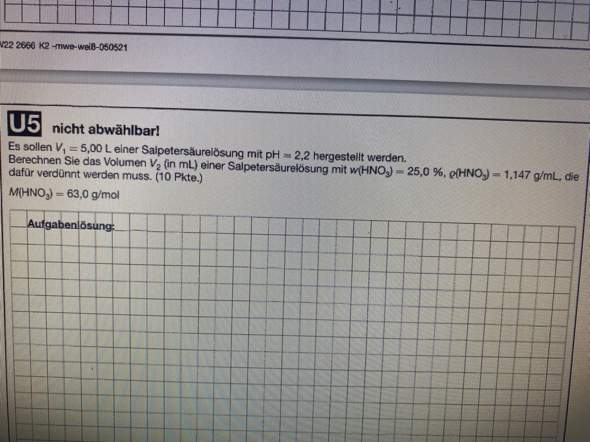
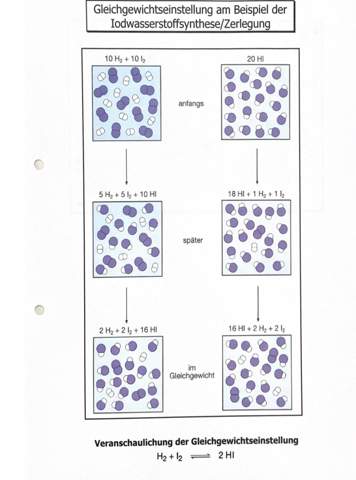
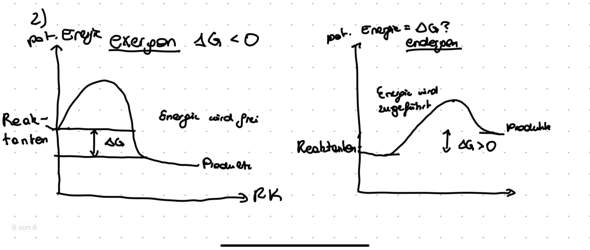
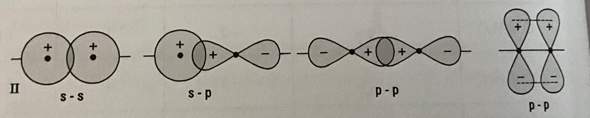
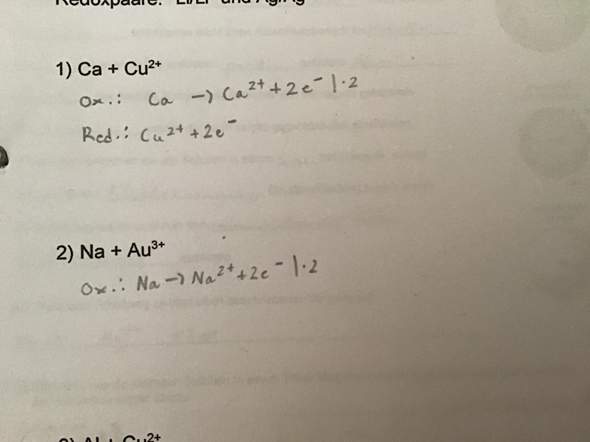Man sollte meinen, der ausführliche Rechenweg wäre genug, aber ich habe trotzdem ein paar ganz wichtige Dinge nicht zuordnen können.
Ich berechne, soweit ich das verstehe, bei n(NH3) die Stoffmenge, die durch das HCl verbraucht wurde, also 0,05 mol. Bei n(NH4+) darunter setzte ich das einfach mit diesem Wert gleich, denn wenn soviel mol NH3 verbraucht wurden, müssen in der Lösung auch soviel NH4+-Teilchen sein. Ich habe nur nicht ganz verstanden, welche Werte es sind, die ich in die Hasselbalch-Gleichung einsetzen soll, da in der Aufgabe ja alles 0,05 mol sind. Die nBase könnten ja die 0,05 mol sein, die noch übrig sind, oder die die verbraucht wurden. Und die nSäure könnten die 0,05 mol HCl sein, die zugesetzt wurden, oder die 0,05 mol NH4+, die sich gebildet haben. Soweit ich weiß, ist der Wert ja meistens gleich, weil sich ja soviel NH4+ bildet, wie auch Säure hinzugesetzt wird. Aber sicher bin ich mir nicht. Und bei nBase bin ich mir wie gesagt auch nicht sicher.
In einer anderen Aufgabe sind es beispielsweise 0,7mol CH3COOH (pKs=4,75). Diesen wird 0,1 mol NaOH zugesetzt. Ich habe pH(nach Basenzugabe)=4,75+lg(0,1mol/0,6mol)=3,97 gerechnet. Die 0,6 mol habe ich so gerechnet: 0,7 (Säurestoffmenge) - 0,1 (Basenstoffmenge). Macht das Sinn oder muss ich andere Werte einsetzen?
Entschuldigung für die vielen Fragen.