Wie sieht eine exergone und eine endergonische Reaktion aus?
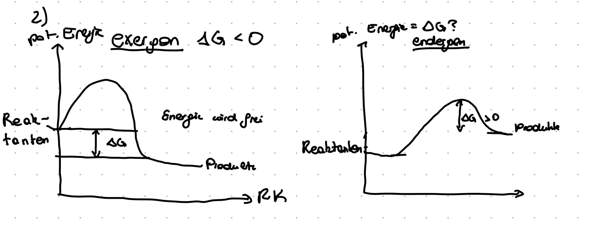
Hallo! Ich habe hier ein Diagramm der potentiellen Energie einer endergonischen und einer exergonischen Reaktion gezeichnet. Stimmt das so? Und wenn ja könnte mir jemand erklären wieso man Delta G an dieser Stelle zeichnet?
Danke im Voraus!
2 Antworten
Delta G ist der Energieunterschied zwischen Ausgangs- und End-Energieniveau. Der "Höcker" stellt die Aktivierungsenergie dar.
Der Unterschied ist, dass eine exergone oder auch exotherme Reaktion Energie abgibt, einer endergonen oder auch endothermen Reaktion initial Energie zugeführt werden muss. Delta G ist der Energieunterschied.
Ich gebe zu, dass Chemie, auch wenn es der Leistungskurs war, jetzt fast 30 Jahre zurückliegt. Ich müsste mich dann doch noch einmal wieder einlesen 😕
Wobei bei der zweiten Reaktion Delta G eigentlich zwischen Reaktanten und Produkt liegen müsste. Ich bin verwirrt.
Ich dachte allerdings, dass auch endotherm Reaktionen exergon sein können?