pH-Wert einer Pufferlösung aus NH3 und NH4Cl?

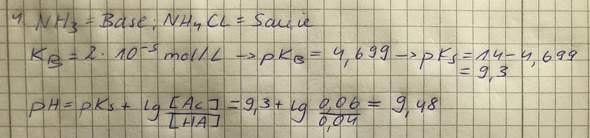
Ich habe einen pH-Wert von ca. 9,5 raus, was ich mir eigentlich nicht vorstellen kann. Soweit ich weiß, ist Ammoniak keine starke Base und sowohl das Cl, als auch das NH4 bilden ja starke Säuren. Muss ich eventuell bei der Säure die doppelte Konzentration nehmen, weil ich sowohl Cl, als auch NH4 habe?
1 Antwort
Von gutefrage auf Grund seines Wissens auf einem Fachgebiet ausgezeichneter Nutzer
Wasser, Salz, Labor
Bei mir kommt pH=9.48 heraus, also hast Du wohl richtig gerechnet. Das ist ein moderat alkalischer pH (etwas näher bei 7 als bei 14), und ergibt sich daraus, daß NH₃ eine schwache Base ist (NH₃-Lösungen ohne NH₄Cl-Zusatz sind deutlich basisch, pH≈11) und mit seinem Salz NH₄Cl einen Puffer bildet. Das Cl¯-Ion tut dabei gar nichts, weil es realistischerweise weder eine Säure noch eine Base sein kann.