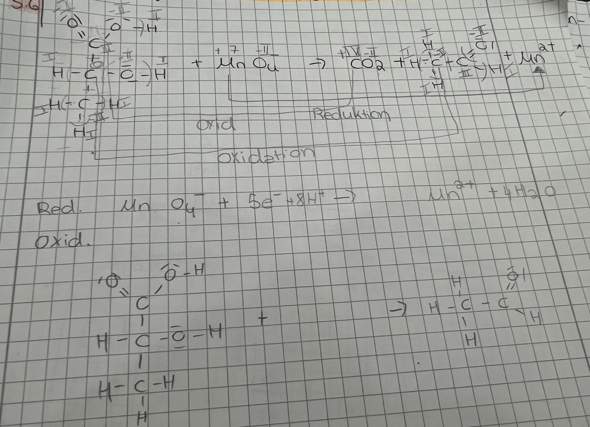Hallo liebe Chemiker,
ich habe mich in letzter Zeit einmal mit Redoxreaktionen beschäftigt (10. Klasse). Mir fällt es nicht besonders schwer, Redoxreaktionen aufzustellen. Aber den chemischen Hintergrund zu verstehen- das finde ich dann schon schwieriger.
Als Beispiel habe ich die Reaktion von Kupfer und Salpetersäure zu Kupferionen und Stickstoffdioxid.
Mir geht es besonders um die Reduktion, welche bekanntlich so aussieht:
HNO3 + e- + H+ —> NO2 + H2O
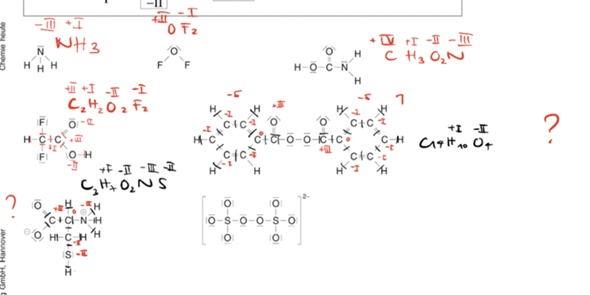
Da sich die Oxidationszahl von Stickstoff von V auf IV nimmt es ein Elektron auf, welches mit einem H-Ion ausgeglichen werden muss.
Das finde ich aber ziemlich schwer sich vorzustellen. Das Stickstoffatom nimmt ja schließlich kein Elektron auf. Stattdessen wird eines der Elektronen aus der Elektronenpaarbindung mit dem „verlorenen“ Sauerstoffatom nun nicht mehr stärker von jenem angezogen. Wenn Stickstoff „wirklich“ ein Elektron aufgenommen hätte, müsste sich doch auch die tatsächliche Ladung ändern, oder?
Das gleiche Problem stellt sich mir auch bei dem positiv geladene H-Ion: Zusammen mit dem „verlorenen“ H-Atom und O-Atom bildet es ein Wassermolekül. Müsste dieses Wassermolekül nicht dann auch einfach positiv geladen sein?
Für mich würde die Teilreaktion daher mehr Sinn machen, wenn sie so aussehen würde:
HNO3 + H —> NO2 + H20
Vielleicht kann mir jemand erklären, wo mein(e) Denfehler liegt.
LG