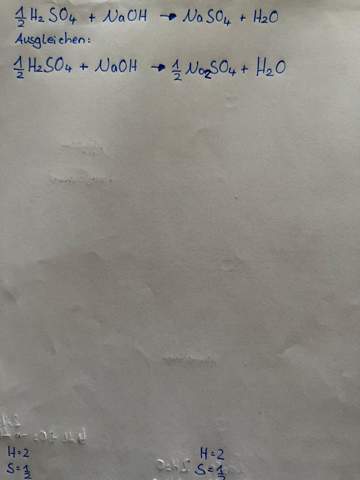Aufgabe 1
Beim Haber-Bosch-Verfahren wird Ammoniak (NH3) aus den Elementen Stickstoff und Wasserstoff hergestellt. Die Gleichgewichtskonstante dieser Reaktion beträgt K = 9,6 L'/mol bei 300 °C.
Formulieren Sie die Reaktionsgleichung für diese Gleichgewichtsreaktion
Stellen Sie das Massenwirkungsgesetz für diese Reaktion auf und berechnen Sie die Gleichgewichtskonzentration von Stickstoff, wenn die weiteren Gleichgewichtskonzentrationen bei 300 °C wie folgt lauten: (Wasserstoff) = 0,09 mol/L, (Ammoniak) = 0,02 mol/L
ergebnis bei mir : 0, 00072 mol/L
Aufgabe 2
Ethin (C2H2) ist ein farbloses Gas, das unter anderem zum Schweißen benutzt wird.
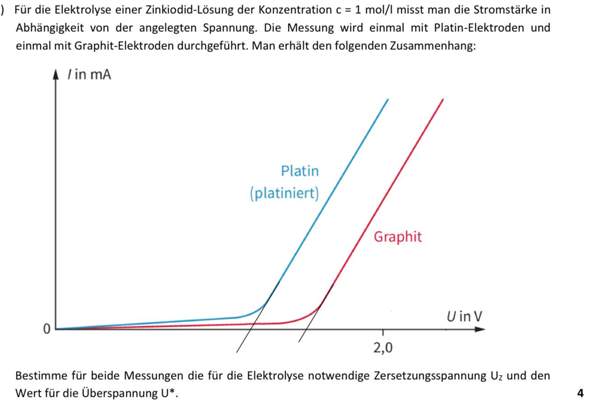
Formulieren Sie die Reaktionsgleichung für die Verbrennung von Ethin.
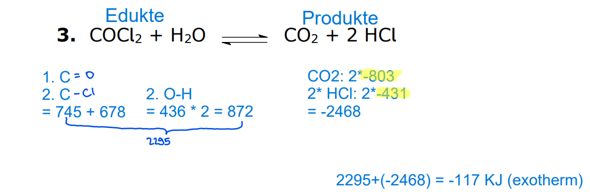
Berechnen Sie die molare Reaktionsenthalpie AHn für diese Reaktion - unter der Annahme, dass beide Reaktionsprodukte gasförmig vorliegen.
meine
2 C2H2 + 5 O2 --> 4 CO2 + 2 H2O
delta h m = - 1255.5 kJ/mol