Formen von elementarem O2?
Hallo,
ich habe eine Frage und zwar über die drei Formen von elementarem O2.
Also die Frage lautet: Begründen Sie, warum es drei Formen von elementarem O2 gibt.
Meine Antwort : Aufgrund der unterschiedlichen Anordnung der Sauerstoffmoleküle.
- O2 die häufigste Form von Sauerstoff auf der Erde (über eine Doppelbindungen miteinander verbunden).
- O3 es entsteht wenn Sauerstoffmoleküle durch ultraviolette Strahlung in der oberen Atmospäre gespalten werden.
Was ist die 3.?
Kann vielleicht jmd. mir helfen?
Danke im Voraus.
3 Antworten
Hm, also die Frage kann man auf zwei Arten interpretieren.
1. Es ist Sauerstoff und nicht O2 gemeint, also ist nach Allotropen gefragt. Das wären bei Sauerstoff neben dem bekannten O2 noch Ozon O3. Dann gibt es noch O1, das in der Hochatmosphäre bzw. eigentlich schon im Weltraum über der Erde durch UV-Strahlung gebildet wird und unter anderem Satelliten korrodiert. Außerdem gibt es O4 und O8, die aber nur unter extremen Bedingungen auftreten.
2. Es ist tatsächlich O2 gemeint, dann wäre die Antwort Triplett- und Singulett-Sauerstoff. Von letzterem gibt es zwei Formen. Nämlich einmal den mit zwei Elektronen in einem π*-Orbital und einmal den mit je einem Elektron pro π*-Orbital und antiparallelen Spins. Grund wäre hier die verschiedenen Möglichkeiten die zwei Elektronen auf die beiden π*-Orbitale zu verteilen.
O₂ kommt in drei Formen vor:
- als paramagnetischer Triplett-Sauerstoff mit 2 ungepaarten Elektronen mit gleichem Spin in 2 antibindenden π-Orbitalen. Er ist ein Diradikal.
- als diamagnetischer Singulett-Sauerstoff mit 2 ungepaarten Elektronen mit ungleichem Spin in 2 antibindenden π-Orbitalen. Er ist ein Diradikal.
- als diamagnetischer Singulett-Sauerstoff mit einem Elektronenpaar mit natürlich ungleichem Spin in einem antibindenden π-Orbitalen. Er ist kein Radikal.
Stabil ist, dem Radikalcharakter zum Trotz, nur der Triplett-Sauerstoff.
Ozon O₃ ist ein ganz anderes Thema. Eher einfacher sogar, weil es da keine stabilen Radikale gibt.
Im Übrigen kannst du weder im O₂ noch im O₃ die Atome verschieden "anordnen", die Anordnung ist fest, von Molekülschwingungen abgesehen.
.... O3, bekannt auch als Ozon hat eine Dreifachbindung.
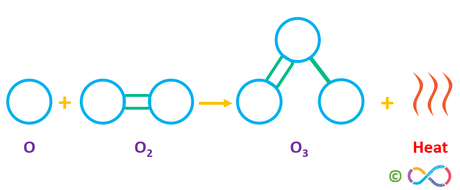
mfe
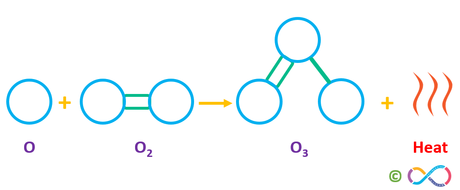
... an den drei Atomen.
die Fragestellung hab ich gelesen, es wurde Ozon genannt, es wurde nach der 3 gefragt, das hab ich illustriert.
Das sind eine Doppel- und eine Einfachbindung. Eine Dreifachbindung gibt es im Ozon-Molekül nicht...
Und es wurde nach der dritten Form von elementarem O2 gefragt, nicht nach der 3 in O3
vielleicht möchte der/die Fragesteller*in das bewerten...
Wo genau siehst du da eine Dreifachbindung? Außerdem hat der Fragesteller doch Ozon schon genannt...