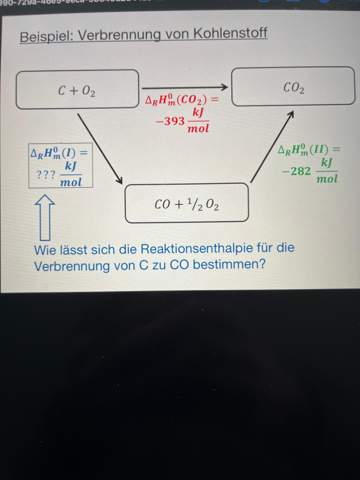
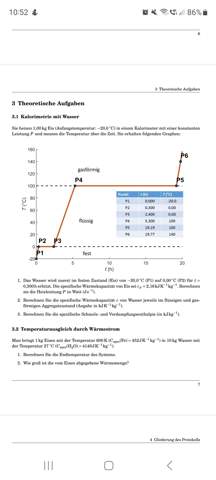
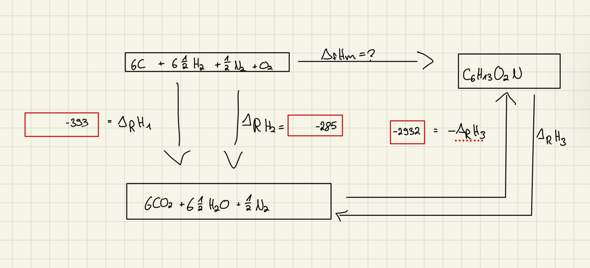
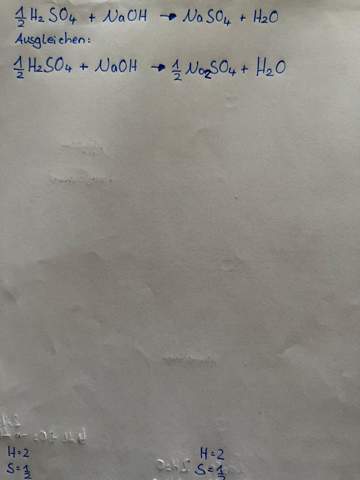Hallo, ich stehe vor folgender Aufgabe zum Carnot-Zyklus:
Für den Carnot-Zyklus werden folgende Größen definiert: Die Temperaturen des heißen und des kalten Wärmereservoirs (Th bzw. Tk), das Gasvolumen zu Beginn, Vi, und nach Abschluss des 1., 2. und 3. Schrittes, V´, V´´ bzw. V´´´, nach dem 4. Schritt ist wieder Vi erreicht. Im 1. Schritt wird eine isotherme Expansion des Gases bei Th vorgenommen und im 2. eine adiabatische, dabei wird Tk erreicht. Der 3. Schritt entspricht einer isothermen und der 4. Schritt einer adiabatischen Kompression, es wird wieder Th erreicht. Alle Schritte werden reversibel durchgeführt.
a) Berechne für das System (Gas) für jeden Schritt die Arbeit und die ausgetauschte Wärme.
b) Berechne für jeden Schritt auch dU und dS und zeige mathematisch, dass nach Abschluss eines Zyklus dU und dS jeweils gleich Null ist.
c) Zeige mathematisch, dass die Summe über w und q jeweils nicht gleich Null ist.
d) Berechne den Wirkungsgrad.
Zu a) stellt sich mir die Frage, ob ich angesichts der fehlenden Werte nur die Formeln jeweils herleiten soll, bei b) weiß ich gar nicht, wie ich die innere Energie U und die Entropie S berechnen soll; bei c) weiß ich ebenfalls nicht, wie ich w und q berechnen soll bzw was von mir verlangt wird und bei d) stören mich wieder die fehlenden Werte.
Kann mir hier vielleicht jemand einen Hinweis geben? Danke vielmals!