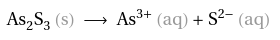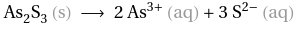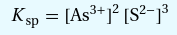Wie berechnet man hier die Konzentration (Löslichkeitsprodukt,Chemie)?
Hallo,
leider verstehe ich hier gerade nicht wie dieser Lösungsweg entstanden ist. Kann mir jemand dabei helfen und eventuell auch erklären warum dieser Lösungsweg ohne irgendwelche Maße das Ergebnis erbracht hat?

2 Antworten
Der pL ist analog zum pH-Wert definiert als pL = -lg(L), wobei L das Löslichkeitsprodukt der Verbindung ist. Und L ist das mathematische Produkt aller Ionen. Das ist also:
(1) L = c(As³)*c(As³)*c(S²⁻)*c(S²⁻)*c(S²⁻) = 4 * 10⁻²⁹ mol⁵l⁻⁵
Ich habe hier die Einheit für das Volumen "l" verwendet, damit es nicht zur Verwechslung mit dem Formelzeichen "L" für das Ionenprodukt verwechselt kommt. Nun gilt ja:
a * a = a² und b * b * b = b³
Somit kann man (1) schreiben als:
(2) L = c²(As³) * c³(S²⁻) = 4 * 10⁻²⁹ mol⁵l⁻⁵
An der Verhältnisformel As2S3 ist erkennbar, dass das Verhältnis der Schwefelionen zu den Arsenionen 3/2 ist. Also:
c(S²⁻) = 3/2 * c(As³⁺)
Daher kann man (2) schreiben:
(3) L = c²(As³⁺) * (3/2c)³(As³⁺) = 4 * 10⁻²⁹ mol⁵l⁻⁵
(4) c²(As³⁺) * 27/8c³(As³⁺) = 4 * 10⁻²⁹ mol⁵l⁻⁵ = 27/8c⁵(As³⁺)
(5) c(As³⁺) = ⁵√(8/27 * 4 * 10⁻²⁹ mol⁵l⁻⁵) = 1,64 * 10⁻⁶ molL⁻¹
Vielleicht ist die Rechnung nun etwas besser nachzuvollziehen. Ist wegen der Faktoren und Potenzen auch irgendwie etwas exotisch und man muss es einfach formal durchziehen, auch wenn man es nicht intuitiv erfasst.
Ok:
1.) Reaktionsgleichung aufschreiben und ausgleichen:
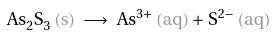
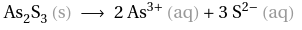
2.) Zuordnen der stöchiometrischen Verhältnisse und der Aktivitäten (achte auf die Potenzen, die nun bei der Aktivität stehen)

(Dabei ist v=-c für die Reaktanden und v=c für Produkte)
3.) Nun die Aktivitäten miteinander Multiplizieren
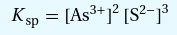
Damit ist das Grundgerüst fertig. Weiter geht es mit Teil 2
K(sp) ist nicht direkt gegeben, also müssen wir das erstmal umrechnen:
K(sp)=28,4 --> pKs=4 x 10 hoch -29 (mol⁵/l⁵)
Du löst die o.g. Gleichung nach As auf und findest die Lösung:
Beachte dabei die stöchiometrischen Koeffizienten also einmal 2 und ein mal 3
K(sp)=(2*A²)*(3*B³)
Umstellen nach A und Wurzel(n) ziehen ;)