Löslichkeitsprodukt?
Moin!
Könnte mir jemanden erklären, wie man auf diesen Term gekommen ist? Ich meine man wisse schon, dass die Konzentration von Fe und OH gleich ist, aber wie man auf das Endergebnis gekommen ist, ist ja die Frage. Danke im Voraus!

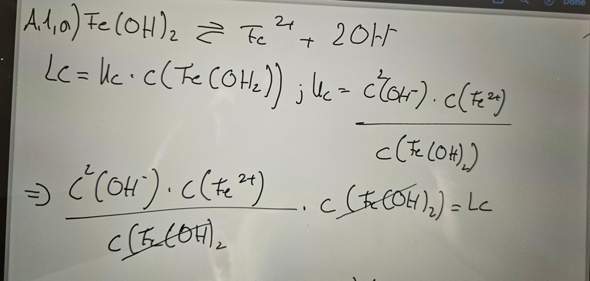
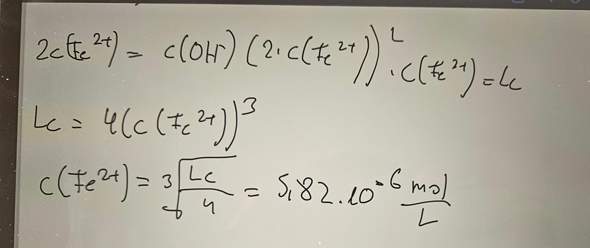
1 Antwort
Wenn sich x mol Fe(OH)₂ pro Liter Wasser lösen, dann ist c(Fe²⁺)=x und c(OH¯)=2x; dazu haben wir angenommen, daß wir die OH¯-Ionen aus der Autoprotolyse vernachlässigen können. Das Löslichkeitsprodukt lautet dann
Kₛₚ = c(Fe²⁺)⋅c²(OH¯) = 4x³ ⟹ x=³√(¼Kₛₚ)=5.8⋅10¯⁶ mol/l
und dazu kannst Du sogar noch einen pH=14−lg(2x)=9.07 ausrechnen.
Du siehst, daß das merklich alkalisch ist, daß also das Fe(OH)₂ wesentlich mehr OH¯ mitbringt als in reinem Wasser bereits enthalten sind (10¯⁷ mol/l). Daher ist die Rechnung vertrauenswürdig, und die gemachte Näherung, daß alle OH¯-Ionen aus dem Fe(OH)₂ kommen und die aus der Autoprotolyse vernachlässigt werden können, rechtfertigt sich hinterher von selbst.