Polarität in der Carboxy-Gruppe?
Meine Lehrerin meinte, Moleküle mit Carboxygruppen reagieren im Gegenteil zu Alkoholen sauer
der grunde: das O-Atom mit der Doppelbindung zieht die Elektronen von der. C—OH auch zu sich (und das das Restion stabiler ist)
Das erscheint mir iwi unlogisch, da es ja beides O-Atome sind, die EN-Differenz also null beträgt und die Elektronen von jedem O-Atom gleich stark angezogen werden
Meine Idee: Das O-Atom mit der Doppelbindung polarisiert das C-Atom positiv was zur Folge hat, dass das C-Atom die Elektronen der C—OH Bindung ansich zieht
Wer hat recht und wieso?
Danke
3 Antworten
Keiner. Der Grund warum eine Carboxygruppe sauer reagiert ist, dass das resultierende Anion resonanzstabilisiert ist. Dadurch kann es die negative Ladung auf beide Sauerstoffatome verteilen. Der Alkohol kann das nicht und gibt daher sein Proton weniger gern ab.
Kurzer Nachtrag: EN-Differenzen gelten nur für die Bindung zwischen zwei Atomen. Es ist also nur diese Bindung polarisiert, nicht das ganze Atom. Man kann daraus nicht direkt auf Auswirkungen auf benachbarte Bindungen schließen.
Hab eben noch einen Nachtrag geschrieben. Beantwortet das deine Frage?
Jein, also unsere Lehrerin hat uns das so als einen Grund erklärt das es sauer reagiert weil bei der OH-Bindung es stärker polarisiert wie bei Ethanol
Aber wie kommt es dazu?
Sagen Dir die Begriffe mesomere oder induktive Effekte etwas? Wenn ja, findest Du auch dort eine Teilantwort
Tut es nicht. Die ist genauso polarisiert. Wie gesagt EN-Differenzen sind nur für einzelne Bindungen anwendbar und das ist ja beides eine O-H Bindung. Die Tendenz sauer zu reagieren kommt ausschließlich von der Stabiliserung des Anions.
Sieht man z.b. bei Phenol. Das ist deutlich saurer als Ethanol. Und das obwohl beide nur eine OH-Gruppe haben, die nicht weiter polarisiert wird als normal.
Ja aber ich versteh nicht wieso es da einen induktiven Effekt gibt?
Mir wurde es so erklärt, dass wegen der hohen Dichte des O-Atoms mit der Doppelbindung, dieses Atom weitere Elektronen anzieht
Ich hab explizit nachgefragt und sie meinte so was wie gleiches will zu gleichem
Ich dachte mir halt das das positiv polarisierte Atom die Elektronen der C—OH Bindung zu sich ziehen würde und deswegen das Proton leichter abspaltbar wäre
Ausschließlich? Aber warum lernen wir das dann so dumm 🤪
Keine Ahnung wer die Lehrpläne schreibt, aber wahrscheinlich werden induktive und mesomere Effekte auf das Reaktionsverhalten als zu kompliziert angesehen und man behilft sich mit einfacheren Erklärungen. Aus demselben Grund lernt man ja auch das Schalenmodell obwohl das seit 100 Jahren überholt ist.
Das C in der Cabroxygruppe zieht also keineswegs Elektronen nach, nur weil es von einem O mit Doppelbindung polarisiert ist. Im Gegenteil. Dadurch, dass da zwei O dran hängen, wird es noch mehr positiv polarisiert und das macht es zu einem exzellenten Angriffspunkt für Nucleophile. Mit der Säurewirkung hat das also nicht wirklich was zu tun.
so stehts in userem Buch:
Bindungspolaritäten in Ethansäure-Molekülen
Die Fähigkeit eines Teilchens, als Säure zu reagieren, ist unterschiedlich stark ausgeprägt. Das Maß dafür bezeichnet man als Acidität (acidus (lat.): sauer). Ein Ethansäure-Molekül enthält insgesamt vier Wasserstoff-Atome.
Welches davon ist für die Acidität der Moleküle verantwortlich?
Die 3 H-Atome am Alkylrest sind alle an ein Kohlenstoffatom gebunden
Kohlenstoff-Atom haben jeweils eine Elektronegativitätsdifferenz von 0,4 und sind somit weitgehend unpolar
(B3). Das Wasserstoff-Atom in der Carboxy-Gruppe ist an ein Sauerstoff-Atom gebunden. Die Elektronegativi-tätsdifferenz dieser Bindung beträgt
1,4. Die Bindung ist polar.
In der Carbonyl-Gruppe werden die beiden Elektronenpaare der Kohlen-stoff-Sauerstoff-Doppelbindung aufgrund der hohen Elektronegativität des Sauerstoff-Atoms zu diesem hingezogen (B4). Diese elektronen-ziehende Wirkung beeinflusst auch die Elektronen der benachbarten Kohlenstoff-Sauerstoff-Einfachbindung und zieht diese in Richtung des Kohlenstoff-Atoms. Dies führt wiederum zu einer verstärkten Polarisierung der Bindung zwischen dem Sauerstoff- und dem Wasserstoff-Atom. Das Wasserstoff-Atom der Carboxy-Gruppe kann aufgrunddessen leicht als Proton abgespalten werden. Es entsteht ein sogenanntes Carboxylat-lon, hier das Ethanoat-lon.
Also ist für die stärkere positive Polarisierung des Wasserstoff-Atoms der Induktive Effekt des anderen Sauerstoff-Atoms verantwortlich?
I-Effekt ist ein Faktor ja. Du kannst ja die Säurestärke einer Carbonsäure auch durch Wahl der Reste am Carboxyl-C beeinflussen. Die Resonanzstabiliserung ein zweiter Faktor.
Nur über EN-Differenzen darf man da nicht argumentieren. Die sind nur aussagekräftig für einzelne Bindungen.
Wobei man aber nicht vergessen darf, dass I und M Effekte natürlich auch auf das Anion wirken und dessen Stabilität beeinflussen. Man kann also viel daran rumspielen wenn man entsprechende Reste anbaut.
Sorry
Bedeutet Induktiver Effekt dass das C-Atom dann positiv polarisiert ist und deswegen die C—OH E- zu sich zieht
oder dass die Anziehungskraft wirklich noch vom O-Atom ausgeht? Wenns letzteres ist versteh ichs nicht weil es ja zwei atome mit derselben EN ist, die Differenz wäre ja 0?!
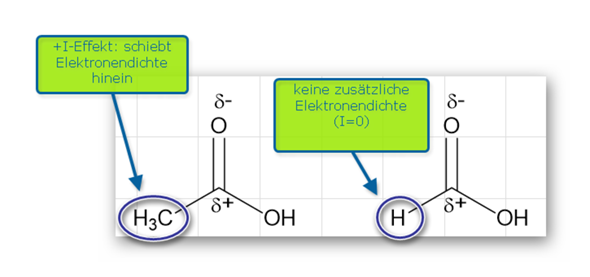
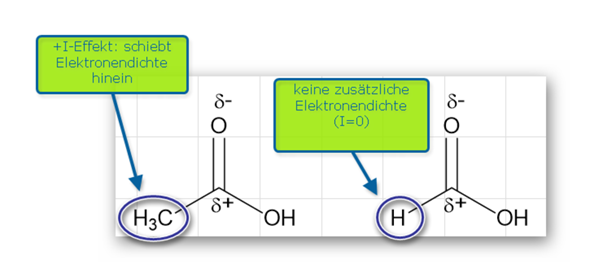
Induktiver Effekt bedeutet, dass Elektronen weggeschoben oder angezogen werden. -I heißt das Atom oder die Gruppe zieht Elektronen zu sich und +I entsprechen schiebend.
Das O hat einen -I Effekt, zieht also Elektronen zu sich. Das geht auch über die direkte Bindung hinaus. Alkylgruppen haben einen +I Effekt. Das Carboxyl-C ist aber alleine und mach somit im Endeffekt nichts was I-Effekt hätte. Es kriegt also von beiden Seiten Elektronen abgezogen. Die beiden Os kämpfen also mehr miteinander über das C hinweg. Die positive Polarisierung vom C ist das Resultat davon und hat damit keine Auswirkung.
Da sich die beiden Os jetzt um Elektronen boxen, wird natürlich auch an den Elektronen der O-H Gruppe gezogen. Zum Nachteil des H versteht sich.
Die gesamte Carboxygruppe hat übrigens auch einen -I-Effekt.
Aber es müsste ja ein komplettes Kräftegleichgewicht zwischen den beiden Sauerstoff atomen herrschen?
Dann wäre das H im Endeffekt ja nicht stärker als bei Wasser polarisiert?
Nicht so ganz. Ich versuchs mal bildlich zu machen.
Wenn du dir eine C-O-H Bindung anschaust, dann hat O die mit Abstand höchste Elektronegativität und damit den höchsten -I-Effekt. Die höchste Elektronendichte dieser Konstellation liegt also überm O.
Bei der C=O Bindung ist es dasselbe, die höchste Elektronedichte liegt beim O.
Der Punkt kommt jetzt wenn du sie kombinierst, dann hast du O=C-O-H. Das O hat jetzt auf einmal was, das von der anderen Seite an seinen Elektronen zieht. Damit verschiebt sich die Elektronendichte ein Stück Richtung des anderen O (wichtig: nicht auf das C, nur in diese Richtung). Heißt also für die O-H Bindung: Vorher lag die Elektronendichte mitten im O, jetzt wird die weggezogen, aber auch weg vom H. Das heißt, das H hat jetzt noch weniger Elektronendichte als vorher.
Ok danke, ich versteh alles außer dem Punkt wo es kombiniert wird
Wieso zieht nicht das O der Hydroxy an den E der Doppelbindung?
hab hier mal aufgezeichnet wie ich das meine. Der blaue Kreis ist jeweils die hohe Elektronendichte am O. An den Elektronen der Doppelbindung wird schon auch gezogen.
Achsoooooo es zieht sich schon an, nur eben gleichermaßen stark
Danke 🙏 das hat mir sehr geholfen, du hast den Stern gesichert
Also keine Garantie ob das jetzt so ganz korrekt gezeichnet war, aber zum Verständnis reichts
Ich möchte mal den Ansatz von meinem Kollegen hier etwas näher betrachten oder ergänzen.
Carbonsäuren werden mit zunehmender Kettenlänge weniger sauer, weil der +I-Effekt des Alkylrestes zunimmt. Angesichts dessen ist die Abspaltung des Protons immer schwerer, da die Bindung zwischen dem Sauerstoff und Wasserstoffatom gestärkt wird. Vergleichst Du Essig- und Ameisensäure miteinander, wo haben beide unterschiedliche pKs-Werte, wegen der zusätzlichen Alkylgruppe.
Beim Alkohol hast Du zwei Faktoren, die mit hineinspielen: Einerseits ist die konjugierte Base stark, auch sie bekommt Elektronendichte vom Alkylrest, weswegen die Säurestärke hier eher sehr gering ist. Die Abspaltung des Protons ist hier aufgrund der wenig polarisierten Bindung wenig begünstigt.
Andererseits ist das Sauerstoffatom relativ klein und muss eine negative Ladung tragen und bekommt auch noch durch den Alkylrest Elektronendichte zugeschoben. Das ist energetisch ungünstig, denn wie soll die Ladung ohne Probleme auf der geringen Oberfläche ohne elektrostatische WW effizient verteilt werden?
Und warum steigt der I+ Effekt mit zunehmender Alkyl-Größe?
Weil Alkylgruppen generell gute Elektronendonatoren sind. Da ich nicht weiß, wie weit Du in der Materie steckst, belasse es erstmal mit der Erklärung, sonst verwirrt Dich dies. Merk Dir einfach: Je mehr eine (polare) Bindung zu einem H-Atom gestärkt wird, desto weniger azide wird dieses Proton sein.
Rest-Ion ist stark basisch, bedeutet das, dass es viele Rückreaktionen gibt?
Wie JenerDerBleibt richtigerweise geschrieben hat, ist die Carbonsäure deutlich saurer als ein alkoholisches R-OH, weil das Anion durch Mesomerie stabilisiert ist.
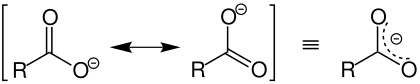
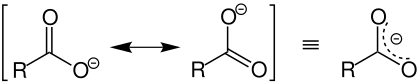
Das wurde im Unterricht auch als eine der Gründe angeführt
der zweite war aber:
Beim O-Atom mit der Doppelbindung ist die Elektronendichte hoch, deswegen zieht es die Elektronen der C—OH Bindung auch noch in seine Richtung
Klingt für mich nur bedingt logisch
Ist das richtig, wenn ja warum, wenn nein wie ist es richtig und warum?
2 elektronegative O-Atome ziehen natürlich stärker Elektronen als nur eines. Das C ist im Falle der Säure daher stärker positiv polarisiert als beim Alkohol. Und wenn in Alphaposition noch stark elektronegative Fluor- oder Chloratome sitzen, wird die Säure dadurch noch acider. Trifluoressigsäure ist mit einem pKs-Wert von 0,23 fast so stark wie Salpertersäure (pKs = -1,3).
Das auch aber wie funktioniert das mit der Polarisierung?