ist viel fleisch essen gut oder schlecht bei diabetes?
14 Stimmen
7 Antworten
Hallo ohjee332, 👋
ist viel fleisch essen gut oder schlecht bei diabetes?
"Diabetes" ist nur ein Überbegriff für mehrere
(12), verschiedene Diabetes-Erkrankungen/Typen.
Die häufigsten sind Typ 1 + 2.
Welche DM-Erkrankung meinst du?
💉Typ1-Diabetes (Autoimmunerkrankung)?
💊Typ2-Diabetes (Stoffwechselerkrankung)?
"Viel Fleisch" zu essen ist prinzipiell für
alle Menschen eher schlecht, als gut.
Typ1-Diabetiker können sich genauso
ernähren, wie gesunde Nicht-Diabetiker.
Typ2-Diabetiker sollten genauso wie viele
Kohlenhydrate viel fettes Fleisch meiden,
wenn sie übergewichtig sind (was bei
~ 80 % der Fall ist) und abnehmen wollen.
~~~~~~~
LG 🙋🏻♀️🪶
Bereits der tägliche Verzehr von etwa 56 Gramm verarbeitetem Fleisch, erhöht das Risiko für Diabetes um 19 Prozent und das Risiko für Herzkrankheiten um 42 Prozent.
Erst einmal: Zucker kann kein Typ 2 Diabetes verursachen. Das ist biochemisch nicht möglich. Die wissenschaftlich kausale Ursache ist Fett, egal woher es kommt: Nahrungsfette, vom Körperfett produzierte Fette, vom Zucker umgewandelte Fette. Diese Fette führen zur mitochondrialen Dysfunktion, Insulinresistenz, Lipotoxizität, Hyperinsulinämie, Hyperglykämie, gesteigerten Fettproduktion und Glukoseproduktion in der Leber.
Wie Typ 2 Diabetes wirklich entstehtInsulinresistenz: Seit 1927 ist wissenschaftlich bekannt, dass Nahrungsfette eine Insulinresistenz verursachen. Circa 70 Jahre später, als man z.B. mit der ¹H-NMR-Spektroskopie in die Zellen schauen konnte, um zu gucken was da eigentlich passiert, war auch der Mechanismus bekannt:
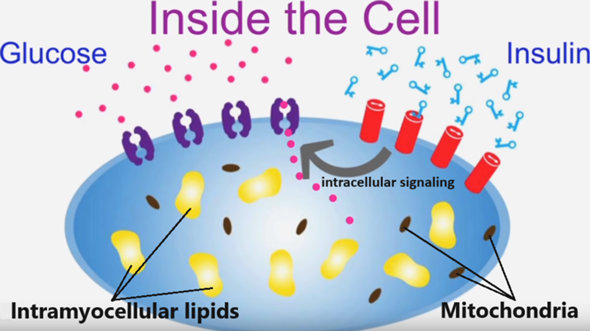
Bei fettreichen Mahlzeiten gelangen, anstelle der Glukosemoleküle, die Fettsäuren in die Muskel- und Leberzellen – intra(myo)zelluläre Lipide – und produzieren freie Radikale und toxische Abbauprodukte (Lipidmetabolite) wie Diacylglycerine und Ceramide, die das Funktionieren der Insulin-Signalwege erschweren, indem die inneren Insulinrezeptoren blockiert und die Enzyme der Insulinrezeptoren, die eigentlich die GLUT4 Glukosetransporter aktivieren sollen, gehemmt werden. Das von der Bauchspeicheldrüse produzierte Insulin bindet dann zwar an den Insulinrezeptoren außerhalb der Zellen, aber im Inneren der Zellen passiert nichts. Die Folge: Insulin wird wirkungslos, als Ausgleich wird mehr Insulin benötigt und produziert (Hyperinsulinämie), und Glukose sammelt sich im Blut an (Hyperglykämie).


Warum werden Zucker und Übergewicht mit Diabetes in Verbindung gebracht?
Wenn man eine Menge Bauchfett hat, ist dieses Bauchfett metabolisch aktiv und produziert entzündungsfördernde Zytokine (Interleukin-1, Interleukin-6), die zusätzlich die Insulinrezeptoren außerhalb der Zellen stören, und Fettsäuren, die Insulinresistenz fördern.
Zucker wird bei gesunden Menschen nicht in Fett umgewandelt, sondern erst, wenn man im Kalorienüberschuss ist, wenn man isolierte Fruktose (z.B. hunderte Gramm Fruchtzuckerpulver) zu sich nimmt, oder wenn die Fettproduktion (De-novo-Lipogenese) in der Leber durch Insulinresistenz oder Fettleber gesteigert ist. Dieses Fett fördert Insulinresistenz.
Insulin Deficiency and Insulin Inefficiency
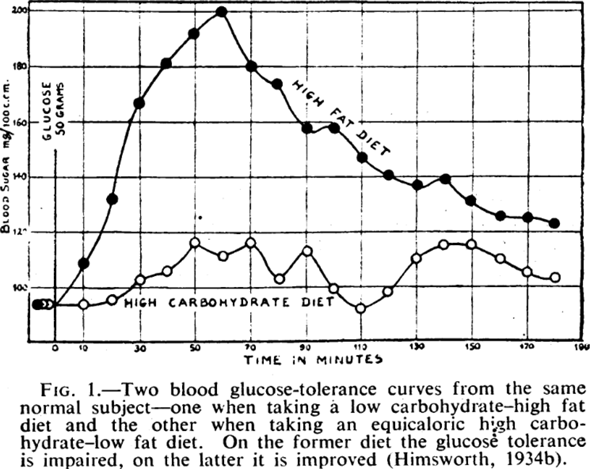
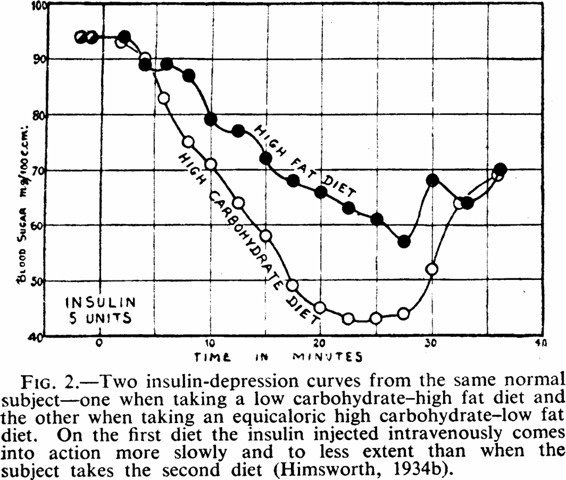
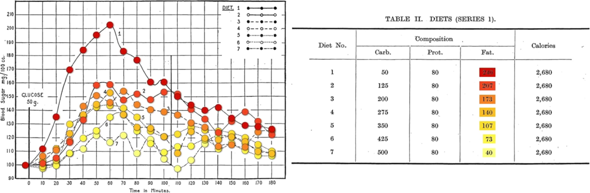
1940: Erstmals 1927 fand man heraus, dass das Fett in der Ernährung die Glukosetoleranz beeiträchtigt, weswegen der Blutzuckerspiegel nach fettreichen Mahlzeiten stärker ansteigt und langsamer sinkt.

Abbildung 1: Zwei Blutzucker-Toleranzkurven desselben Probanden: Bei der kohlenhydratarmen, fettreichen Diät ist die Glukosetoleranz beeinträchtigt, bei der kohlenhydratreichen, fettarmen Diät ist sie verbessert.

Abbildung 2: Zwei Insulin-Depressionskurven desselben Probanden: Bei der kohlenhydratarmen, fettreichen Diät wirkt das intravenös gespritzte Insulin langsamer und in geringerem Maße als bei der kohlenhydratreichen, fettarmen Diät.
DIETARY FACTORS THAT INFLUENCE THE DEXTROSE TOLERANCE TEST
1927: Bei der Gruppe mit der fettreichen Ernährung schoss die Glukoseintoleranz in die Höhe. Bei gleicher Zuckerwassermenge reagierte sie mit einem doppelt so hohen Blutzuckerspiegel.
Relationship of dietary saturated fatty acids and body habitus to serum insulin concentrations: the Normative Aging Study
1993: Würde der Anteil der gesättigten Fettsäuren an der Gesamtenergie von 14% auf 8% sinken, so würde das Nüchterninsulin nach einer Mahlzeit um 18% und das postprandiale Insulin um 25% abnehmen. Sowohl Körperfett als auch der Verzehr von gesättigten Fettsäuren können einen Insulinüberschuss im Blut verursachen. Wenn wir den Konsum gesättigter Fettsäuren reduzieren, können wir diesen Prozess unterbrechen. Eine Verringerung der Aufnahme von gesättigten Fettsäuren hat erhebliche Auswirkungen auf den Insulinspiegel und die Senkung des Bedarfs an überschüssigem Insulin, unabhängig davon, wie viel Bauchfett wir haben.
Mechanism of free fatty acid-induced insulin resistance in humans
1996: Es wurde festgestellt, dass eine erhöhte Konzentration freier Fettsäuren im Plasma eine Insulinresistenz durch Hemmung des Glukosetransports verursacht.
Intramyocellular lipid concentrations are correlated with insulin sensitivity in humans: a 1H NMR spectroscopy study
1999: Bei gesunden Jugendlichen geht eine akute Erhöhung der freien Fettsäuren im Plasma (durch eine Intralipid-Infusion) mit einem signifikanten Anstieg der intramyozellulären Lipide und einer Verringerung der Insulinsensitivität einher, unabhängig von der ethnischen Zugehörigkeit.
Rapid impairment of skeletal muscle glucose transport/phosphorylation by free fatty acids in humans
1999: Nach nur 3 Stunden kann es passieren, dass Fett eine Insulinresistenz verursacht, indem die Glukoseaufnahme gehemmt wird.
Overnight lowering of free fatty acids with Acipimox improves insulin resistance and glucose tolerance in obese diabetic and nondiabetic subjects
1999: Reduziert man den Fettgehalt im Blut, verringert sich die Insulinresistenz und der Blutzucker.
Plasma fatty acid composition and incidence of diabetes in middle-aged adults: the Atherosclerosis Risk in Communities (ARIC) Study
2003: Nach Anpassung für Alter, Geschlecht, BMI, Verhältnis von Taille zu Hüfte, Alkoholkonsum, Zigarettenrauchen, körperliche Aktivität, Bildung, Vorgeschichte von Diabetes in der Familie, war die Diabetesinzidenz signifikant und positiv mit den Anteilen der Cholesterinester und der Fettsäuren der Phospholipide im Plasma verbunden.
Impaired mitochondrial activity in the insulin-resistant offspring of patients with type 2 diabetes
2004: Die Insulinresistenz im Skelettmuskel ist mit einer Dysregulation des intramyozellulären Fettsäurestoffwechsels verbunden. Dieser Anstieg des intramyozellulären Lipidgehalts war höchstwahrscheinlich auf eine mitochondriale Dysfunktion zurückzuführen.
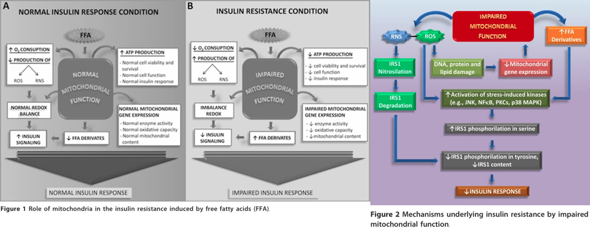
Mechanisms underlying skeletal muscle insulin resistance induced by fatty acids: importance of the mitochondrial function
2012: Ein erhöhter Gehalt an freien Fettsäuren im Plasma spielt eine wichtige Rolle bei der Entwicklung einer Insulinresistenz der Skelettmuskulatur. Eine Insulinresistenz wird mit der Entwicklung verschiedener Syndrome wie Fettleibigkeit, Typ-2-Diabetes und metabolisches Syndrom in Verbindung gebracht. Für die durch Fettsäuren induzierte Insulinresistenz der Muskeln wurden mehrere Mechanismen postuliert, darunter der Randle-Zyklus, oxidativer Stress, Entzündungen und mitochondriale Dysfunktion.

Abbildung 1: Die Rolle der Mitochondrien bei der durch freie Fettsäuren induzierten Insulinresistenz: Im Normalzustand verstoffwechseln Mitochondrien freie Fettsäuren effizient und mit geringer Produktion reaktiver Sauerstoffspezies (ROS), wodurch die Insulinreaktion erhalten bleibt. Im pathologischen Zustand führen hohe Plasmaspiegel freier Fettsäuren zu einer erhöhten Aufnahme in die Zellen und Mitochondrien. Dies beeinträchtigt die mitochondriale Biogenese und Funktion, reduziert die oxidative Kapazität und führt zur Anhäufung von Lipidmetaboliten sowie einer gesteigerten ROS- und reaktiven Stickstoffspezies (RNS)-Produktion. Die Folge ist die Aktivierung von Proteinkinasen, die die Insulin-Signalübertragung durch fehlerhafte Phosphorylierung und Nitrosilierung des Insulinrezeptorsubstrats-1 (IRS-1) stören, was letztlich die Insulinantwort beeinträchtigt.
Effects of an overnight intravenous lipid infusion on intramyocellular lipid content and insulin sensitivity in African-American versus Caucasian adolescents
2013: Gibt man Fett in den Blutkreislauf von Jugendlichen, sammelt es sich in ihren Muskelzellen an und reduziert ihre Insulinsensitivität. Hohe Blutfettwerte spielen eine wichtige Rolle bei der Insulinresistenz, sowohl bei gesunden als auch bei übergewichtigen Menschen, mit oder ohne Typ 2 Diabetes.
Dietary fat acutely increases glucose concentrations and insulin requirements in patients with type 1 diabetes: implications for carbohydrate-based bolus dose calculation and intensive diabetes management
2013: Nahrungsfette erhöhen akut die Glukosekonzentration im Blut und den Insulinbedarf.
Skeletal intramyocellular lipid metabolism and insulin resistance
2015: Die in Skelettmuskelzellen gespeicherten Lipide werden als intramyozelluläre Lipide bezeichnet. Störungen im Zusammenhang mit den intramyozellulären Lipiden und ihrem ursächlichen Faktor, den zirkulierenden freien Fettsäuren im Blutkreislauf, führen zu einem toxischen Zustand und letztlich zu einer Insulinresistenz im Muskelgewebe.
https://www.youtube.com/watch?v=3igKW6bl3FE
Schon nach wenigen Stunden einer fettreichen Mahlzeit entwickelt sich eine kurzzeitige Insulinresistenz. Die isolierten Fettsäuren aus den Ölen kommen am schnellsten ins Blut. Eine chronisch hohe Fettaufnahme kann zu einer dauerhaften Insulinresistenz führen, wenn der Fettstoffwechsel ständig gestört ist, und man verliert die Fähigkeit, Kohlenhydrate richtig zu verstoffwechseln.
LipotoxizitätDie Lipotoxizität ist ein Zustand, der durch die schädliche Wirkung von überschüssigen Fettsäuren auf Gewebe und Organe verursacht wird, insbesondere bei Menschen mit Diabetes oder Insulinresistenz. Sie tritt auf, wenn der Körper zu viele freie Fettsäuren produziert oder nicht richtig verarbeiten kann, was zu einer Ansammlung von Fetten in nicht dafür vorgesehenen Geweben führt, wie etwa der Leber, der Bauchspeicheldrüse, den Muskeln und dem Herzen, und sie trägt zur Verschlimmerung der Stoffwechselstörungen bei Diabetes bei und ist mit verschiedenen negativen Auswirkungen verbunden:
- Erhöhte Insulinresistenz: Fettansammlungen in der Leber und den Muskeln stören den Glukosestoffwechsel und erhöhen die Insulinresistenz.
- Schädigung der Betazellen: In der Bauchspeicheldrüse führen Fettsäuren zu einem Verlust der Insulinproduktion.
- Entzündungen: Die Fettablagerungen und die toxischen Derivate führen zu Entzündungsreaktionen, die die Gewebe weiter schädigen.
- Herz-Kreislauf-Erkrankungen: Die Lipotoxizität kann auch die Funktion des Herzens und der Blutgefäße beeinträchtigen und das Risiko für Herz-Kreislauf-Erkrankungen erhöhen.
Fatty acids and glucolipotoxicity in the pathogenesis of Type 2 diabetes
2008: Obduktionsstudien zeigen, dass die Zahl der Betazellen bei der Diagnose von Typ-2-Diabetes bei etwa 50% liegt und nach vielen Jahren auf etwa 20% abnimmt. Die Endozytose von LDL-Cholesterin kann durch die Bildung von ROS (freien Radikalen) zum Absterben der Betazellen führen. In ähnlicher Weise beeinträchtigte eine anhaltende Erhöhung der zirkulierenden nicht-veresterten freien Fettsäuren durch Lipidinfusion die Funktion der insulinproduzierenden Betazellen, insbesondere bei Personen mit einer genetischen Veranlagung. Eine westliche Ernährung, reich an gesättigten Fetten, führt zu Fettleibigkeit, Insulinresistenz und erhöht die Konzentration der freien Fettsäuren.
The long lifespan and low turnover of human islet beta cells estimated by mathematical modelling of lipofuscin accumulation
2009: Nach ungefähr 20 Jahren haben wir bereits alle insulin-produzierenden Betazellen in unserer Bauchspeicheldrüse. Es werden keine neuen produziert.
mTOR: from growth signal integration to cancer, diabetes and ageing
2010: Tierische Proteine sind übermäßig mit der Aminosäure Leucin angereichert, die das mTOR Enzym überstimuliert und zum Absterben der Betazellen führt. Pflanzen haben von Natur aus wenig Leucin.
Death protein 5 and p53-upregulated modulator of apoptosis mediate the endoplasmic reticulum stress-mitochondrial dialog triggering lipotoxic rodent and human β-cell apoptosis
2012: Gesättigte Fettsäuren steigern das Betazell-abtötende Death Protein 5 (DP5). Gesättigte Fettsäuren schaden den Betazellen, sodass diese nicht mehr angemessen auf die Kohlenhydrate, die wir zu uns nehmen, reagieren können.
Lipotoxicity: effects of dietary saturated and transfatty acids
2013: Gesättigte Fettsäuren steigern lipotoxische freie Fettsäuren, die toxisch auf unsere Betazellen wirken. Fettsäurederivate können die Funktion der Betazellen beeinträchtigen und letztlich zu ihrem Tod durch Lipoapoptose führen.
Saturated free fatty acid sodium palmitate-induced lipoapoptosis by targeting glycogen synthase kinase-3β activation in human liver cells
2013: Gesättigte Fettsäuren wie Natriumpalmitat, die vor allem in Fleisch und Milchprodukten enthalten sind, sind fast durchgängig toxisch in Zellkulturen, während die einfach ungesättigten Fettsäuren wie Oleat, die in Oliven, Nüssen oder Avocados enthalten sind, entweder nicht toxisch oder sogar zytoprotektiv sind. Die durch die gesättigte Fettsäure Natriumpalmitat induzierte Lipoapoptose in menschlichen L02- und HepG2-Zellen wird durch eine GSK-3β-Aktivierung reguliert, die zur JNK-Aktivierung und Bax-Hochregulierung führt.
Low Protein Intake Is Associated with a Major Reduction in IGF-1, Cancer, and Overall Mortality in the 65 and Younger but Not Older Population
2014: Eine hohe Proteineinnahme steigert die Sterblichkeit um 75%, die Wahrscheinlichkeit an Krebs zu sterben um 300%, die Wahrscheinlichkeit an Diabetes zu sterben um 400%. Ursache ist der Anstieg von IGF-1 durch tierische Proteine.

Je mehr Fett, trotz weniger Kohlenhydrate, desto höher der Blutzucker.
Die effektivste BehandlungHigh-carbohydrate, high-fiber diets for insulin-treated men with diabetes mellitus
1979: Diabetiker bekamen eine fettarme, kohlenhydratreiche, ballaststoffreiche Ernährung mit über 300 Gramm Kohlenhydraten und 18 Gramm Fett (9% ihrer Kalorien) am Tag: Die tägliche Insulindosis wurde bei jedem der 20 Patienten niedriger. Die Insulintherapie konnte bei 11 Patienten abgesetzt werden, wovon 9 Patienten vorher 15-20 Einheiten/Tag und 2 Patienten 32 Einheiten/Tag hatten. Die Nüchternblutzuckerspiegel und 3-stündigen postprandialen Blutzuckerspiegel waren bei den meisten Patienten niedriger, trotz niedrigerer Insulindosen. Die Serumcholesterinwerte sanken von 206 mg/dl auf 147 mg/dl.
Veganism and its relationship with insulin resistance and intramycellular lipid
2004: 24 Veganer gegen 25 Omnivore (gleiches Geschlecht, Alter, Taillenumfang, BMI, Körperfett, Aktivitätslevel, Kalorienanzahl): Veganer aßen 10% mehr Kohlenhydrate, hatten trotzdem niedrigere Nüchternblutzuckerspiegel, 30% signifikant weniger intramyozelluläre Lipide, niedrigeren systolischen Blutdruck. Ihre Ernährung schützte die Betazellen der Bauchspeicheldrüse und das Herz-Kreislauf-System.
A Low-Fat Vegan Diet Improves Glycemic Control and Cardiovascular Risk Factors in a Randomized Clinical Trial in Individuals With Type 2 Diabetes
2006: Die Verbesserungen der Blutzucker- und Lipidkontrolle bei Typ-2-Diabetikern waren bei einer fettarmen, kohlenhydratreichen, veganen Ernährung größer als bei einer Ernährung, die auf den Richtlinien der American Diabetes Association (Diabeteswissenschaftler) orientiert.
A low-fat vegan diet and a conventional diabetes diet in the treatment of type 2 diabetes: a randomized, controlled, 74-wk clinical trial
2009: Die Veganer hatten 31% weniger intramyozelluläre Lipide als die Nicht-Veganer, die einer klassischen Ernährung gegen Diabetes folgten.
(2/4) Eine Fettleber steht im engen Zusammenhang mit einer Insulinresistenz. Die Ursachen für Lebererkrankungen wie Fettleber sind Cholesterin und gesättigte Fettsäuren, nicht Zucker.
Nonalcoholic fatty liver disease
2002: Abbildung 2 Panel B: Die aus der Insulinresistenz resultierende Hyperinsulinämie erhöht die Fettsäuresynthese (De-novo-Lipogenese) in den Hepatozyten durch Steigerung der Glykolyse und begünstigt die Anhäufung von Triglyceriden in den Hepatozyten durch Verringerung der hepatischen Produktion von Apolipoprotein B-100.
Dietary habits and their relations to insulin resistance and postprandial lipemia in nonalcoholic steatohepatitis
2003: Die Nahrungsaufnahme der 25 Patienten mit nicht-alkoholischer Steatohepatitis (NASH) enthielt mehr gesättigte Fettsäuren und Cholesterin, weniger mehrfach ungesättigte Fettsäuren, Ballaststoffe und antioxidative Vitamine C und E. Der Insulinempfindlichkeitsindex war bei NASH-Patienten signifikant niedriger als bei den Kontrollpersonen. Die Triglyzeridwerte waren bei NASH-Patienten höher als bei den Kontrollpersonen. Die Aufnahme gesättigter Fettsäuren korrelierte mit dem Insulinempfindlichkeitsindex, mit den verschiedenen Merkmalen des metabolischen Syndroms und mit dem postprandialen Anstieg der Triglyceride. Die postprandiale Reaktion auf Apolipoprotein B-48 und Apolipoprotein B-100 war bei NASH-Patienten flach und deutlich von der Triglyceridreaktion abgekoppelt, was auf einen Defekt der ApoB-Sekretion schließen lässt. Ernährungsgewohnheiten können die Steatohepatitis direkt durch die Modulation der hepatischen Triglyceridakkumulation und der antioxidativen Aktivität sowie indirekt durch die Beeinflussung der Insulinempfindlichkeit und des postprandialen Triglyceridstoffwechsels fördern.
Pathogenesis of type 2 diabetes: tracing the reverse route from cure to cause
2008: Die Insulinresistenz begünstigt die Entwicklung einer Fettleber bei einem Kalorienüberschuss. Ist die Insulinresistenz erst einmal etabliert, wird die erhöhte Insulinsekretion - die zur Aufrechterhaltung des Plasmaglukosespiegels erforderlich ist - die Fettablagerung in der Leber weiter verstärken. Die Fettleber führt zu einer Resistenz gegen die Unterdrückung der hepatischen Glukoseproduktion durch Insulin sowie zu einem erhöhten Triacylglycerinspiegel im Plasma. Wenn die Betazellen erhöhten Mengen an Fettsäuren ausgesetzt sind, die aus zirkulierendem und lokal abgelagertem Triacylglycerin stammen, wird die glukosevermittelte Insulinsekretion unterdrückt. Die Insulinresistenz beschleunigt das Fortschreiten der Fettleber, wobei ektopische Fettablagerungen in Leber und Betazellen eine zentrale Rolle bei der Insulinresistenz und Betazelldysfunktion spielen. Der Verzehr einer hyperkalorischen Ernährung, reich an gesättigten Fetten, hängt, im Rahmen eines genetischen Hintergrunds, kausal mit der Entstehung von Typ-2-Diabetes zusammen.
(3/4) The Gordian Knot of dysbiosis, obesity and NAFLD
2013: Wenn man Fett isst, füttert man die schlechten Bakterien im Darm, die Entzündungen fördern und zu einem durchlässigen Darm (Leaky Gut) beitragen. Dadurch wird das angeborene Abwehrsystem in der Leber aktiviert und die Leber nimmt Schaden auf zellulärer Ebene. Abbildung 2: Umweltfaktoren wie Nahrungsfette können bei einer nicht-alkoholischen Fettleber eine Dysbiose auslösen und die Durchlässigkeit des Darms erhöhen. Dieser Schritt führt zur Verlagerung von pathogen-assoziierten molekularen Mustern wie Lipopolysaccharid, die Toll-like-Rezeptoren auf verschiedenen Leberzellpopulationen aktivieren können. Es wird angenommen, dass die Aktivierung von Toll-like-Rezeptoren auf Kupffer-Zellen eine Entzündung auslöst, und die Aktivierung von Toll-like-Rezeptoren auf stellative Leberzellen stimuliert die Fibrose.
Non-high-density lipoprotein cholesterol independently predicts new onset of non-alcoholic fatty liver disease
2013: Um sich von der toxischen Wirkung von Cholesterin zu schützen, schüttet der Körper das Cholesterin ins Blut aus, somit kann man mit dem Messen des non-HDL-Cholesterins schätzen wie verfettet die Leber ist. Keine Patienten mit einem non-HDL-Cholesterin von kleiner als 130 mg/dl entwickelten eine nicht-alkoholische Fettleber.
Cholesterol-induced non-alcoholic fatty liver disease and atherosclerosis aggravated by systemic inflammation
2014: Cholesterin lagert sich nicht nur in der Arterien ab, sondern auch in der Leber.
Typ 1 Diabetes Behandlung
Auch Typ 1 Diabetiker entwickeln eine Insulinresistenz, wenn sie sich fettreich ernähren, deswegen sollten sie sich fettarm, kohlenhydratreich, ballaststoffreich ernähren, um weniger Insulin spritzen zu müssen.
Low Carb beseitigt zwar die Symptome, verstärkt aber die Insulinresistenz. Die Ketonkörper bei einer ketogenen Ernährung können zwar die intramyozellulären Lipide aus den Zellen bekommen – die Insulinresistenz lässt sich also zurückbilden – führen aber zu Nierenerkrankungen und Osteoporose. Beide Ernährungsformen fördern außerdem Cholesterinspiegel, Herz-Kreislauf-Erkrankungen, Krebs, Retinopathie und andere Krankheiten, und sind daher nicht zu empfehlen.
Video: Warum man Typ 2 Diabetes auf keinen Fall mit LowCarb oder Keto behandeln sollte
(4/4) Wie Typ 1 Diabetes entsteht
Intakte tierische Aminosäuren kommen hauptsächlich durch eine durchlässige Darmwand (Leaky Gut Ursachen) ins Blut, die durch Alkohol, gesättigte Fettsäuren, Cholesterin und schlechte Darmbakterien durch Tierprodukte und Antibiotika entsteht. Antikörper werden von den Lymphozyten gesendet, um die tierischen Aminosäuren anzugreifen, und lösen dabei eine molekulare Mimikry aus. Dabei kopieren die tierischen Aminosäuren die Aminosäurestruktur der Betazellen, sodass die Antikörper nun nicht nur die tierischen Aminosäuren im Blut, sondern auch die Betazellen der Bauchspeicheldrüse als Feind erkennen und zerstören.
A bovine albumin peptide as a possible trigger of insulin-dependent diabetes mellitus
1992: Das Casein aus der Kuhmilch hat genau die gleichen 17 Aminosäuren wie die Betazellen unserer Bauchspeicheldrüse. Alle Diabetiker hatten erhöhte Serumkonzentrationen von IgG-Anti-BSA-Antikörpern und IgA-Antikörpern. Patienten mit insulinabhängigem Diabetes mellitus haben eine Immunität gegen Kuhmilchalbumin, mit Antikörpern gegen ein Albuminpeptid, das mit einem Betazell-spezifischen Oberflächenprotein reagieren kann. Solche Antikörper können an der Entwicklung einer Inseldysfunktion beteiligt sein.
1994: Die frühe Einführung von Milchprodukten und ein hoher Milchkonsum in der Kindheit erhöhen die Kuhmilch-Antikörperspiegel und sind mit hohen IgA-Antikörpern gegen Kuhmilch-Formula, unabhängig voneinander, mit einem erhöhten Typ-1-Diabetes-Risiko verbunden.
1996: Eine spezifische Proliferation von T-Lymphozyten mit Rinder-Beta-Casein wurde bei Patienten mit Typ 1 Diabetes festgestellt. Der Zusammenhang zwischen Typ 1 Diabetes und einem frühem Kuhmilchkonsum lässt sich möglicherweise durch die Entstehung einer spezifischen Immunantwort auf Beta-Casein erklären. Die Exposition gegenüber Kuhmilch löst eine zelluläre und humorale Anti-Beta-Casein-Immunantwort aus, die mit einem Betazell-Antigen kreuzreagieren kann. Es gibt Sequenzhomologien zwischen Beta-Casein und mehreren Betazell-Molekülen.
Preservation of beta-cell function in type 1 diabetes
1999: Typ 1 Diabetes wird durch eine autoimmune Zerstörung der Betazellen verursacht, die bereits Jahre vor der vollständigen Zerstörung der Betazellen einsetzt. Der frühe Kontakt zu Kuhmilch wurde als umweltbedingter Auslöser für die autoimmune Zerstörung der Betazellen identifiziert.
2003: Kuhmilchproteine erhöhen bei Säuglingen das Risiko, eine Allergie gegen Milchproteine zu entwickeln. Wegen des möglichen Zusammenhangs zu Typ 1 Diabetes wird in Familien mit einer starken Vorgeschichte dringend empfohlen zu stillen und handelsübliche Kuhmilch und Produkte, die intaktes Kuhmilchprotein enthalten, im ersten Lebensjahr zu meiden.
2004: Bei Tierversuchen wurde gezeigt, dass Milchprotein eine Autoimmunreaktion auslösen kann. Die Lymphozyten können Antikörper produzieren die sowohl das Milchprotein als auch die Myelinscheiden angreifen. Dadurch sterben auch die Nerven im Gehirn ab und man entwickelt Multiple Sklerose.
Dr. John McDougall über Autoimmunerkrankungen allgemein:
"Arthritis ist weder eine Erbkrankheit noch ein unvermeidlicher Teil des Älterwerdens. Es gibt Ursachen für diese Gelenkbeschwerden, und sie liegen in unserer Umwelt. Unser engster Kontakt mit unserer Umwelt ist unsere Nahrung. Einige Forscher glauben, dass rheumatoide Arthritis vor 1800 nirgendwo auf der Welt existierte (1). Es ist gut dokumentiert, dass diese Formen der Arthritis in der ländlichen Bevölkerung Asiens und Afrikas früher selten bis gar nicht vorkamen (2,3,4). Noch 1957 wurde in Afrika kein Fall von rheumatoider Arthritis gefunden. Zu dieser Zeit ernährten sich die Menschen in Afrika noch von Getreide und Gemüse. Den ersten Fall von Lupus in Afrika gab es 1960. Diese einstmals unbekannten Gelenkerkrankungen treten nun immer häufiger auf, da die Menschen in wohlhabendere Länder auswandern oder in die Großstädte ihrer Heimatländer ziehen. Mit diesen Veränderungen haben sie ihre traditionelle Ernährung mit Getreide und Gemüse zugunsten von Fleisch, Milchprodukten und stark verarbeiteten Lebensmitteln aufgegeben, wodurch die Häufigkeit von rheumatoider Arthritis in Dritte-Welt-Ländern weiter steigt (5,6,7). So sind zum Beispiel Afroamerikaner in den USA führend in der Häufigkeit von Lupus, obwohl dies vor 1960 in Afrika unbekannt war (8,9). Die Mechanismen, durch die eine ungesunde Ernährung eine entzündliche Arthritis hervorruft, sind komplex und kaum erforscht, betreffen aber unseren Darm und unser Immunsystem."
Das kann man nicht pauschal sagen. Fettes, kalorienreiches Fleisch kann für Übergewicht sorgen, was einer der Risikofaktoren für Diabetes ist. Wenn man es ordentlich brät, grillt oder frittiert, entstehen schädliche Stoffe wie "Advanced Glycation Endproducts", die die negativen Folgen von Diabetes fördern können.
Gegen Geflügel und mageren Fleisch ist nichts einzuwenden, solange sie keine anderen gesunden Nahrungsmittel verdrängen.
…. Risikofaktoren für Diabetes ist.
… Risikofaktoren für Typ2-Diabetes
(Übergewichts-Diabetes) ist.
…. kein Risikofaktor für Typ1-Diabetes ist.
Die Verbindung zwischen Diabetes Typ 1 und Übergewicht ist nicht so stark ausgeprägt wie beim Typ 2, aber zumindest bei einer größeren "Körperform" in der Kindheit vorhanden (+94%, wenn man diverse Faktoren berücksichtigt, statistisch signifikant):
Die Verbindung zwischen Diabetes Typ 1 und Übergewicht ist nicht so stark ausgeprägt…
Es gibt garkeine Verbindung zw. der Autoimmunerkrankung Typ1-Diabetes und Übergewicht, da Typ1-Diabetiker idR schlank, dünn und manchmal untergewichtig sind.
DMT1 entsteht nicht - wie DMT2 - durch Übergewicht, schlechte/ungesunde Ernährung und zu wenig Bewegung. Typ1er haben keine Insulinresistenz.
auch ohne Diabetes wäre es eher ungesund, Massenweise Fleisch kann unser Körper nichtmal wirklich gut verstoffwechseln, also so 20-30 Prozent der Wochennahrung mit Fleisch; Milchanteil sind okay, der Rest sollte Pflanzenkrams sein.
Je nach Lebenssituation.
(1/4) Effect of non-oil-seed pulses on glycaemic control: a systematic review and meta-analysis of randomised controlled experimental trials in people with and without diabetes
2009: Gekochte Bohnen sind ähnlich effektiv bei der Hemmung der a-Glucosidase (Verlangsamung der Zuckeraufnahme) wie das beliebte Antidiabetikum Acarbose.
Regression of Diabetic Neuropathy with Total Vegetarian (Vegan) Diet
2009: Bei einer fettarmen, ballaststoffreichen, rein pflanzlichen Ernährung erfuhren 17 der 21 Patienten mit Typ 2 Diabetes und systemischer distaler Polyneuropathie in nur 4 bis 16 Tagen eine vollständige Linderung der scharfen, brennenden Schmerzen. Das Taubheitsgefühl blieb bestehen, verbesserte sich aber deutlich. Je länger sich die Patienten am Plan hielten, desto mehr verbesserte sich die Linderung. Am 14. Tag waren die Nüchternblutzuckerspiegel bei den 11 Patienten um 35% gesunken. Der Insulinbedarf hatte sich bei der Hälfte der Patienten verringert. Fünf von ihnen benötigten keine blutzuckersenkenden Mittel mehr. Gewichtsabnahme, Serumtriglyceride und Gesamtcholesterin verbesserten sich.
Vegetarian diets and incidence of diabetes in the Adventist Health Study-2
2011: Je weniger Tierprodukte, desto geringer die Häufigkeit für Typ 2 Diabetes.
Higher insulin sensitivity in vegans is not associated with higher mitochondrial density
2013: Veganer haben eine bessere Insulinsensitivität, weniger intrazelluläre Lipide, niedrigere Nüchternblutzuckerspiegel, niedrigere Insulinspiegel und bessere Glukoseaufnahme in den Zellen.
Effect of rice diet on diabetes mellitus associated with vascular disease
2016: Erstmals in den 50ern wurde in der "Rice Diet" Studie gezeigt, dass eine rein pflanzliche, kohlenhydratreiche Ernährung die diabetische Retinopathie zurückbilden kann. 30% der Patienten, die vorher z.B. keine Überschriften lesen konnten, entwickelten wieder eine normale Sicht. Im Vergleich kann unsere moderne Medizin nur das Fortschreiten der Erkrankung verlangsamen, z.B. mit Medikamenten oder einer Laser-Therapie.
Reversal of Pulmonary Hypertension, Diabetes, and Retinopathy after Adoption of a Whole Food Plant-Based Diet
2019: Case Study: Eine Person wurde von Typ 2 Diabetes, diabetische Retinopathie und pulmonale Hypertonie mit einer pflanzlichen Whole Food Ernährung geheilt, was die Medikamente vorher nicht geschafft haben.
Effect of a Low-Fat Vegan Diet on Body Weight, Insulin Sensitivity, Postprandial Metabolism, and Intramyocellular and Hepatocellular Lipid Levels in Overweight Adults
2020: Randomisierte, klinische Studie an 244 Teilnehmern (davon 211 Frauen) im Alter von durchschnittlich 54,4 Jahren und einem BMI von 33,3. Eine fettarme, kohlenhydratreiche, vegane Ernährung (1834 kcal, 75% Kohlenhydrate, 15% Protein, 10% Fett) reduziert das Körpergewicht indem sie die Energieaufnahme reduziert und den postprandialen Stoffwechsel erhöht. Die Veränderungen sind mit einer Verringerung der hepatozellulären Lipide und intramyozellulären Lipide, sowie einer erhöhten Insulinsensitivität verbunden.
Short-Chain Fatty Acids and Their Association with Signalling Pathways in Inflammation, Glucose and Lipid Metabolism
2020: Ballaststoffe aus der Nahrung werden von Darmbakterien im Dickdarm zu kurzkettigen Fettsäuren (SCFAs) umgewandelt und sind damit der wichtigste Faktor in der Ernährung um GLP-1 zu steigern. SCFAs können die Sekretion vom GLP-1 stimulieren, indem sie FFAR2 aktivieren, was indirekt den Blutzuckerspiegel reguliert, indem es die Insulinsekretion erhöht und die Glucagonsekretion der Bauchspeicheldrüse verringert. (Ballaststoffe sind somit effektiver als Ozempic.)
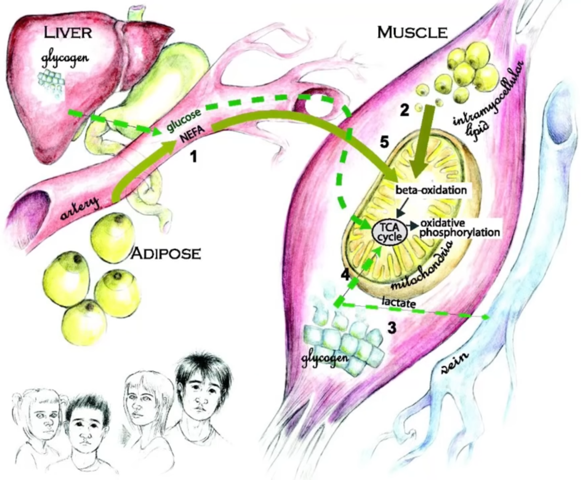
Pathogenese des metabolischen Syndroms: Die Bedeutung der ektopen Fettablagerung in Leber und Skelettmuskulatur
2005: Fett verursacht Metabolisches Syndrom. Abbildung 1: Durch die mitochondriale Dysfunktion in der Skelettmuskulatur von Nachkommen von Typ-2-Diabetikern ist die Fettsäuren-Oxidationskapazität eingeschränkt. Vermehrt anfallende Fettsäuremetaboliten führen zum Auftreten der Insulinresistenz und einer in der Folge verminderten Glukoseaufnahme (1). Auch aus dem Fettgewebe freigesetzte Fettsäuren und Zytokine begünstigen die Insulinresistenz der Skelettmuskulatur (2). Kompensatorisch kommt es zu einer vermehrten Insulinausschüttung aus den β-Zellen des Pankreas (3). Die Hyperinsulinämie fördert jedoch in der Leber die De-novo-Lipogenese, obwohl die Glukoseproduktion der Leber selbst durch die erhöhten Insulinspiegel nicht mehr unterdrückt werden kann («gemischte hepatische Insulinresistenz» [4]). Auch vermehrt aus dem Fettgewebe freigesetzte Fettsäuren und Zytokine fördern die Entstehung einer Fettleber und die hepatische Insulinresistenz (5). Schließlich werden auch die pankreatischen β-Zellen durch die erhöhten zirkulierenden Fettsäuren geschädigt («Lipotoxizität» [6]), und bei nachlassender Insulinsekretion kommt es zum Auftreten eines manifesten Diabetes.