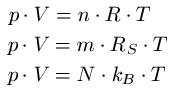Entropie bei adiabatischem Prozess?
Hallo,
Ich habe eine Frage zu folgender Aufgabe:
Betrachte eine adiabatische freie Expansion eines idealen Gases von Volumen V1 nach V2 mit V2>V1. Berechne die Änderung der Entropie a) von Gas b) von Umgebung c) Berechne dS für n=1mol und V2=2*V1.
Leider habe ich absolut keinen Plan davon. Es ist ja ein adiabatischer Prozess, also ist dQ=0, aber die Entropie steigt ja trotzdem, weil es gleichzeitig irreversibel ist, oder? Aber wie mache ich das dann?? Also mit welcher Formel?
Wäre wirklich unendlich dankbar um jede Hilfe
Bin moderat am Verzweifeln
Danke schon mal!!