Reaktion Bernsteinanhydrid mit Ethanol?
Was könnte ein gelungener Samstagabend sein, als sich mit Organik zu beschäftigen?
"Vervollständige die Reaktionsgleichung (Formel und Stoffklasse angeben)
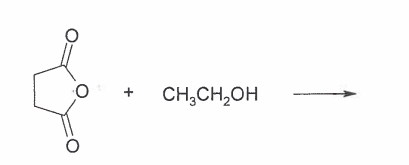
Ok, das Linke ist ja Bernsteinsäureanhydrid. Und Rechts ist Ethanol.
Das Bernsteinsäureanhydrid könnte man ja theoretisch aufspalten, in dem man ein Wasserstoff-Atom an das Sauerstoff-Atom hängt, um den "Ring" entlang der Verbindung zwischen der Sauerstoff-Doppelbindung und dem einzeln gebunden Sauerstoff auufzusplitten Würde dann so aussehen:
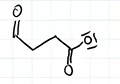
Dadurch dass die Verbindung gesplittet wurde, hat O jetzt ein Elektronenpaar mehr.
jetzt ist die 100000 € - Frage bei Günther Jauch, wie man das Ethanal dranhängen könnte. Ganz links wäre noch eine Bindung frei. Aber der Sauerstoff rechts ist auch unglücklich, weil er ja drei freie Elektronenpaare hat (Statt der üblichen 2).
Habe im internet noch eine ähnliche Reaktion gefunden, da mischt aber leider noch die Essigsäure mit (die wir hier nicht brauchen).
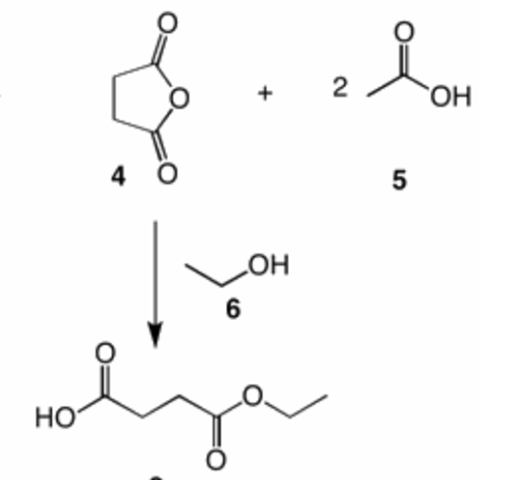
Hat jemand eine gute Idee?
LG,
18Kesnej
2 Antworten
Ich bin mir ziemlich sicher, dass Anhydride mit Alkoholen zu Estern reagieren, und zwar hier unter Ringöffnung
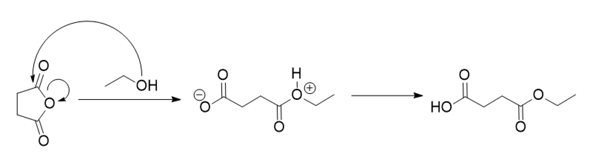
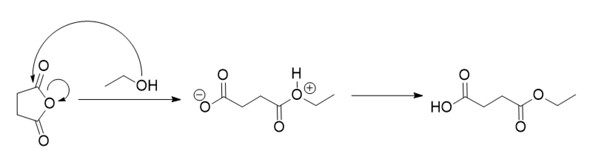
Denk doch mal genau nach, welches O das GANZ rechts nur sein kann, wenn dort die Veresterung stattfindet.
Ja hab auch gedacht, dass das O ganz rechts das OH von der Veresterung ist. Aber das Ding ist das in deiner Graphik ja bei dem Ring eine Bindung durchschnitten wird, worauf das O ein Elektronenmangel hat. Daher hätt ich zunächst vermutetet, daß das O mit dem Elektronenmangel das O ganz links ist und das O ganz rechts von der Veresterung kommt. In deiner Graphik hat jedoch das O ganz rechts bei der Veresterung einen Elektronenmangel, daher bin ich jetzt nicht sicher ob es nicht vielleicht doch das O ist, was vom Ring durchgeschnitten wurde.
Aber das Ding ist das in deiner Graphik ja bei dem Ring eine Bindung durchschnitten wird, worauf das O ein Elektronenmangel hat.
Nein, nicht aufgrund des Durchtrennens. Sondern, weil die OH-Gruppe angreift. Der Sauerstoff des Alkohols erhält die positive Ladung und das ist auch der Sauerstoff, der vom Alk stammt. Du hast hier ganz eklatante Lücken in Deinem Wissen. Du solltest diese unbedingt aufarbeiten, das meine ich nicht böse.
Schau Dir nochmal den Mechanismus an
https://cloud.chemicus.info/index.php/s/9gEdbTDM5OQu8k9
(Anmerkung: es fehlt eine positive Ladung nach Ringöffnung, die hatte ich übersehen, man möge es mir verzeihen)
Danke für die Antwort. Ja, ich habe im Sommersemester angefangen zu studieren. Nicht unbedingt die klügste Entscheidung. Die Veranstaltungen heißen alle "Teil 2" und verlangen Vorwissen aus dem Wintersemester. -.-
Das solltest du nicht machen, Teil 2 baut auf Teil 1 auf und ich rate dir, die Klausur nicht zu schreiben, da du sonst wahrscheinlich mit Pauken und Trompeten untergehen wirst. Lern erstmal die Basismechanismen und dann wird vieles verständlicher.
Du hast formal eine Redoxreaktion durchgeführt, vom Anhydrid zum Aldehyd. Die Zufuhr von Wasserstoffatomen entspricht einer Hydrierung, die Voraussetzungen dafür sind gar nicht gegeben. Das unglückliche Sauerstoffatom mit den drei Elektronenpaaren hat übrigens eine negative Formalladung, die fehlt in der Zeichnung. Das ist dann eine der zwei Resonanzstrukturen einer Carboxylatgruppe. Auf https://youtu.be/gQqXB8IdGC8 wird die säurekatalysierte Reaktion von Methanol und Acetanhydrid gezeigt.
Danke für die Antwort. Mir ist noch nicht so ganz klar, welches "O" das ganz rechts sein soll. Das ist doch das "O" aus dem Ring. Und am dem hängst du jetzt das "H" aus dem Ethanol dran und die Kohlenstoffverbindungen vom Ethanol? Und weil dann eine Bindung zu viel am O ist, schiebst du das H vom O zum linken O ?
Also hängt man nicht Ethanol direkt ran, sondern macht das so schrittweise? Rechts das "H" und die Kohlenstoffe und dann das H nach links schieben?