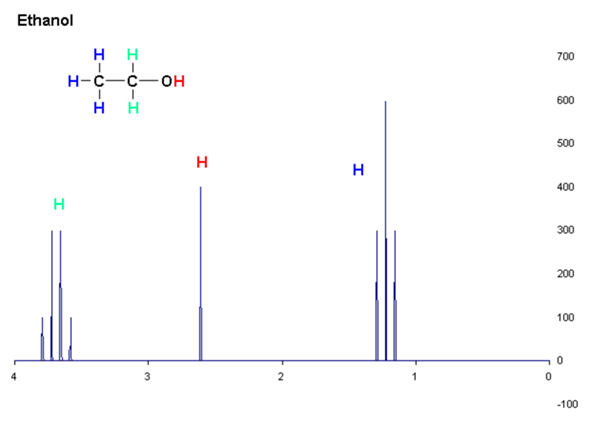
Chemie/Physik 1H-Spektrum von Ethanol?
Eine grundsätzliche Frage zu NMR-Spektren. Warum ist beim 1H-NMR-Spektrum von Ethanol (siehe Bild) das Quartett der Methylen-Gruppe weiter tieffeldverschoben, als das Singulett des Hydroxy-H-Atoms, welches direkt am Sauerstoff sitzt? Ist es nicht so, dass der Sauerstoff benachbarte Kerne aufgrund der hohen Elektronegativität entschirmt und deren Resonanzfrequenz in das Tieffeldschirm, d.h. nach links, schiebt? Das Hydroxy-H-Atom ist doch viel näher am Sauerstoff dran. Dass das Triplett der Methylgruppe ganz rechts ist, kann ich ja nachvollziehen.
2 Antworten
Man findet bei der Bildersuche durchaus auch Bilder, die deinen Erwartungen entsprechen. Ich hatte ein ein solches noch im Kopf.
Nach Kurzrecherche sind das wohl Einflüsse des Lösungsmittels, speziell die Frage, ob das H der OH-Gruppe an Wasserstoffbrücken beteiligt ist.
Nachtrag: Meine Überlegung wäre, dass das kleine OH-Proton dann wieder zu nahe am großen Sauerstoff sitzt und aufgrund der hohen Elektronendichte am Sauerstoff gleichzeitig stark abgeschirmt wird. Es spürt zwar die EN des Sauerstoffes, aber auch gleichzeitig dessen hohe Elektronendichte, die Methylen-H-Atome spüren dagegen nur die Elektronegativität. Kann man das so sagen?