Reaktion von Salpetersäure mit Wasser?
Salpetersäure reagiert mit Wasser als Säure Aber wieso? Das H-Atom am Säuremolekül ist mit einem Sauerstoffatom verbunden
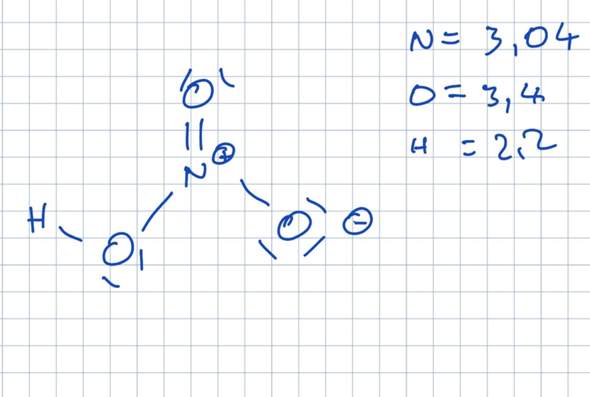
Die Elektronegativitätdifferenz unterscheidet sich ja bei wasser und Salpetersäure beim H nicht
Mir wurde erklärt, dass das Sauerstoff-Atom mit der Formalladung die Bindungselektronen anziehen würde
Ich versteh aber nicht warum, die Differenz ist zwar 0,36 aber das N-Atom ist ja Formal positiv, das müsste ja die Elektronen mehr anziehen
Andersrum müsste ja das O-Atom die Elektronen eher abstoßen da das ganze Atom schon negativ ist
2 Antworten
Wenn Dein Lehrer behauptet, die EN-Differenz sei ausschlaggebend für die Säurestärke, dann frag ihn einmal …
- … warum H₂S eine stärkere Säure als H₂O ist, und H₂Se noch stärker und H₂Te so stark wie Salpetersäure. Die Elektronegativitäten sind O>S>Se>Te
- … warum die Säurestärke von HClO über HClO₂ zu HClO₃ und HClO₄ extrem stark zunimmt — in jedem Fall ist das acide H an ein O gebunden, das wiederum an einem Cl hängt, also wo liegt der Unterschied?
- … warum Ethanol CH₃–CH₂–OH in Wasser keine Säure ist, Essigsäure CH₃–CO–OH aber sehr wohl und Peroxyessigsäure CH₃O–OOH wieder deutlich schwächer ist — sind ja alles OH-Bindungen.
- … warum Alkohole kaum sauer sind, Phenole sehr wohl und warum 2,4,6-Trinitrophenol sogar eine starke Säure ist.
- Sogar Trinitromethan ist eine beachtlich starke Säure, stärker als Phosphorsäure, obwohl das acide H-Atom an einem C hängt und die Elektronegativitätsdifferenz eine unpolare Bindung vorhersagt.
Im Fall (1) liegt es an der steigenden Größe der Chalkogenatome: Im OH¯ muß die negative Ladung am kleinen O-Atom leben, aber im HTe¯ kann sie sich über das ganze vergleichsweise riesige Volumen des Te-Atoms verteilen. Deshalb gibt H₂Te viel leichter ein H⁺ ab.
Die anderen Beispiele haben eine gemeinsame Antwort: Weil die Ladung im Anion auf mehrere Atome verteilt werden kann, im Fall vom Trinitrophenol auf sage und schreibe sieben O-Atome und drei C-Atome. Deshalb ist das Zeug sauer. In den meisten Beispielen kommen vor allem O-Atome als Orte für die Ladung in Betracht, im Fall der Essigsäure trägt jedes der O-Atome im Anion genau −½ Ladung, und das ist viel besser, als wenn eines die ganze Ladung schlucken müßte wie in einem Alkoholat-Ion, das daher nur in nichtwäßrigen Lösungsmitteln stabil ist (weil es so stark basisch ist, daß es sich sofort vom Wasser ein H⁺ klauen würde).
Die Voraussetzung dafür, daß eine solche Ladungsverteilung klappt, ist im wesentlichen das Vorhandensein von genügend Doppelbindungen, so daß man Grenzformeln mit Ladungen an verschiedenen Atomen zeichnen kann („Resonanzstabilisierung“ oder auch „Mesomeriestabilisierung‘ genannt). In erster Näherung heißt daß, daß zwischen dem Ort, ab dem das H⁺ entfernt wird, und dem O-Atom, der einen Teil der negativen Ladung aufnehmen soll, nur konjugierte Doppelbindungen liegen dürfen, also abwechselnd immer eine Einfach- und eine Doppelbindung. Entlang solcher konjugierter Doppelbindungssysteme kann die Ladung effizient herumgeschubst und verteilt werden.
Aber bei zb. Ammoniak und Wasser
das NH2 (heißt das amid-ion?) und oxonium
oder Ammonium und hydroxid, wie kann man es da herausfinden wenn man es nicht kennt, Doppelbindungen gibts ja auch keine
Wer die stärkere Säure ist (also wer wem das Proton aufdrückt), entscheidet sich danach, wer das stabilere Säurerestion hat und nicht danach, wer die höchste EN-Differenz hat.
Du vergleichst also OH- mit NO3-. Und da gewinnt klar letzteres, weil im Nitration die negativen Ladungen über die 3 Sauerstoffatome verteilt werden können. Das OH- kann das nicht.
Meine eigentliche Frage ist, wieso dass H-Atom bei der Säure leichter abspaltbar ist als beim Wasser
okay danke, ist verständlich aber im Unterricht machen wir das immer mit der en-Differenz
Eine polarisierte Bindung ist schon Voraussetzung für die Abspaltung eines Protons, das ist richtig, aber mehr auch nicht. An der EN-Differenz kannst du unmöglich festmachen, welches Molekül in einem Fall wie diesem als Säure reagiert. Hast du ja selbst schon festgestellt.
Dass man das so nicht machen kann sieht man zum Beispiel auch an den Halogenwasserstoffen. Nach der EN-Differenz müsste HF stärker als HI sein. Ist in der Realität aber genau anders rum. HI ist eine sehr viel stärkere Säure als HF.
und wie kann man dass dann rausfinden? Die Stabilität ist ja dann auch dieselbe
Die Stabilität von was? Den Halogenwasserstoffen?
Ganz einfach: Das Iodanion ist ein richtiger Brecher, das Fluoranion ist ziemlich klein. Eine Ladung ist also besser beim Iod aufgehoben, da viel mehr Platz.
Existiert diese Reaktion: HF+HI —> H2F+ und I- ?
Und das mit der Stabilität ist immer anwendbar?
In der Gasphase vielleicht. HF bildet starke Wasserstoffbrücken, dementsprechend wär es eventuell möglich, dass man so eine Spezies erzeugen kann. Aber ob das mit HI geht weiß ich nicht.
Ja, Stabilität ist ja auch der Grund, warum das alles passiert
Also es gibt eine [R-F-R]+ Spezies, wobei R organische Reste sind. Das war aber nur mit Fluorantimonsäure möglich.
Aber woher weiß man dann welche von beiden die stärkere ist?
Mit Fluorantimonsäure wirst du nie was zu tun haben, das musst du also nicht wissen :D oder welche meinst du?
Werde ich wahrscheinlich leider nicht :) ich meinte HI und HF
Ich meine klar man kann messen wie viele Moleküle dissozieren aber welche dann das Proton eher abgibt? Weiß man das nur aus der Theorie oder kann man das mit einer Reaktion bestätigen?
Sowohl als auch. Man kann das quantenmechanisch rechnen und auch praktisch untersuchen.
Es reicht aber auch schon, wenn man sich eben die Größe der Atome/Ionen anschaut. Die werden von oben nach unten im PSE immer größer. Und ein größeres Ion stabilisiert die Ladung besser. Daher ist HI stärker als HF.
In flüssigem HF bildet sich H2F+ von selbst durch Autoprotolyse. Wenn man eine starke Säure zusetzt, nimmt die H2F+-Konzentration natürlich zu.
Danke für die ausführliche Erklärung🙏