Magnetismus von TaCl5 und ReCl3?
Hallo,
kann mir jemand sagen, wie ich auf den Magnetismus von den beiden Stoffen schließen kann? Kann ich über die Struktur darüber schließen?
TaCl5 hat ja kantenverknüpfte Dimmer und ReCl3 trillere Clusterbindung.
Kann sein, dass ReCl3 wegen Metall-Metall-Bindung diamagnetisch ist? Wenn ja warum? Danke, liebe Grüße
1 Antwort
TaCl₅ ist ziemlich sicher diamagnetisch, weil es ein closed-shell-System in der höchstmöglichen Oxidationszahl ist: Alle Valenzelektronen sind im Ta₂Cl₁₀-Molekül als bindende Elektronenpaare verbaut, sagt der Hollman–Wiberg, und das ist nicht viel anders als in Vögeln wie WF₆ oder TiCl₄.
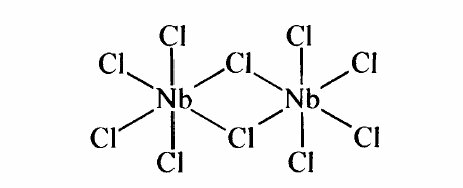
Beim ReCl₃ ist es notwendigerweise komplizierter, weil wir hier nicht die höchstmögliche Oxidationsstufe haben; daher bleiben dem Metall vier d-Elektronen übrig, und die könnten potentiell ungepaarten Spin haben. Die Struktur ist trimer Re₃Cl₉ (L=Cl), und die vier d-Elektronen scheinen in Re=Re-Doppelbindungen verbaut zu sein:
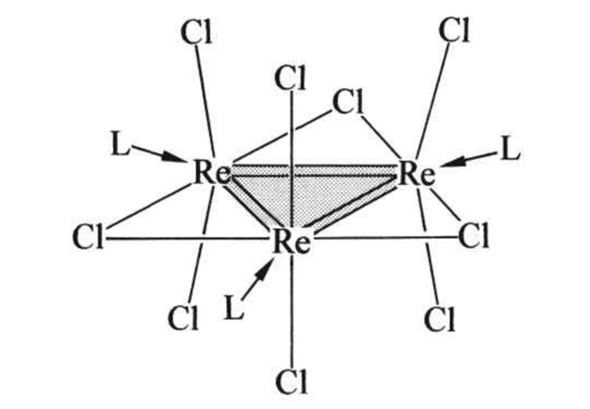
Diese Moleküle sind ziemlich stabil und existieren bis ≈600 °C in der Gasphase; außerdem neigen die schweren Übergangsmetalle ohnehin zu low-spin-Komplexen. Das bringt mich zur Vermutung, daß dieses Biest auch diamagnetisch sein wird, und ich habe ein Paper gefunden, das das beim oberflächlichen Lesen zu bestätigen scheint (Abbildung 1).
Rhenium hat 7 Valenzelektronen und in dieser Verbindung die Oxidationszahl 3, oder anders gesagt, 3 Elektronen werden für die Bindungen zum Chlor gebraucht.
Stabile neutrale Komplexe sind oft diamagnetisch, besonders bei den schweren Übergangsmetallen. Das hängt damit zusammen, daß die 4d- und 5d-Orbitale, anders als 3d, meist energetisch sehr stark aufspalten, so daß low spin günstiger ist. Wenn dann noch die Elektronenanzahl gerade ist, dann wird es diamagnetisch.
Erstmal vielen vielen lieben Dank für die Mühe.... Ich hänge gerade bisschen. Woher weist du, dass beim ReCl3 noch vier Elektronen übrig sind? Und sind stabile Komplexe also in der Regel diamagnetisch?