Magensaft Neutralisation mit Tablette?
Wie viel Liter Magensaft (ph= 2) kann mit einer Tablette gegen Sodbrennen (diese enthält 2 mmol Aluminiumhydroxid und 7 mmol Magnesiumhydroxid) neutralisiert werden?
Hey!
Könnte mir hier jemand weiter helfen?
Ich weiss bereits wie die beiden Stoffe neutralisiert werden müssten.
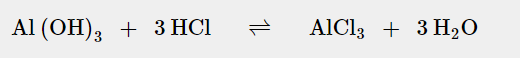
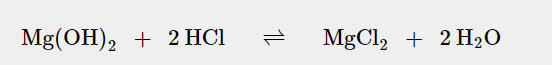
Aber wie komme ich jetzt weiter bei der Berechnung=?
1 Antwort
Der pH-Wert ist gegeben durch:
pH = - log ([H⁺])
vom pH-Wert (hier pH 2) rechnet man wie folgt auf die Konzentration zurück:
[H⁺]= 10⁻ᵖᵸ = 10⁻² mol/L
Die stöchiometrischen Verhältnisse der Neutralisationsreaktionen kennst du bereits.
Bei Aluminiumhydroxid ist das Verhältnis 1:3, bei Magensiumhydroxid ist das Verhältnis 1:2.
Also ergibt sich für die Stoffmenge an Magensäure, die mit dem enthaltenen Aluminiumhydroxid neutralisiert werden kann:
2*10⁻³ mol * 3 = 6*10⁻³ mol
Also ergibt sich für die Stoffmenge an Magensäure, die mit dem enthaltenen Magensiumhydroxid neutralisiert werden kann:
7*10⁻³ mol * 2 = 1,4*10⁻² mol
Somit ergibt sich die Stoffmenge an Magensäure, welche mit den enthaltenen Wirkstoffen neutralisiert werden kann:
1,4*10⁻² mol + 6*10⁻³ mol = 2*10⁻² mol
Wir erinnern uns an die Konzentrations des Magensaftes:
10⁻² mol/L
Mit der Formel c=n/V können wir mit einer Umstellung nach V das Volumen berechnen, welches 2*10⁻² mol Magensäure der Konzentration 10⁻² mol/L enthält, was dann genau dem Volumen Magensäure entspricht, welches mit dem Wirkstoff in der Tablette neutralisiert werden kann:
V = n/C = 2*10⁻² mol / 10⁻² mol/L = 2 L
Also können mit der Tablette gegen Sodbrennen 2 Liter Magensäure neutralisiert werden.
Wow.. das rettet mir den Abend :) Danke!!
Könntest du mir vllt noch bei einer anderen Aufgabe weiter helfen? :>