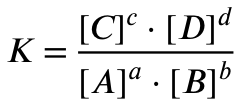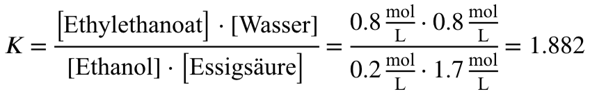Die Reaktionsgleichung sieht wie folgt aus:
1 Ethanol + 1 Essigsäure ⇌ 1 Ethylethanoat + 1 Wasser
Das Massenwirkungsgesetz für eine Gleichgewichtsreaktion der Form
aA + bB ⇌ cC + dD
sieht wie folgt aus:
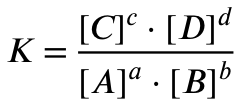
Du setzt also das Produkt der Konzentrationen der Produkte im Gleichgewicht hoch deren stöchiometrischer Vorfaktoren durch das Produkt der Konzentrationen der Edukte im Gleichgewicht hoch deren stöchiometrischer Vorfaktoren ein.
Aus der Reaktionsgleichung geht hervor, dass die stöchiometrischen Vorfaktoren hier 1 sind. Also steht im Exponent eine 1, die musst du dann nicht explizit hinschreiben.
Du weißt, dass sich 1,6 mol deines Esters bilden. Aus der Reaktionsgleichung geht hervor, dass dabei auch 1,6 mol Wasser gebildet werden müssen.
Außerdem geht aus der Reaktionsgleichung hervor, dass du für die Bildung von 1,6 mol Ester auch 1,6 mol Ethanol und 1,6 mol Essigsäure benötigst. Bei einem Kolbenvolumen von 2 L kommst du also auf folgende Gleichgewichtskonzentrationen.
Ethanol: 2 mol - 1,6 mol = 0,4 mol
—> 0,4 mol / 2 L = 0,2 mol/L
Essigsäure: 5 mol - 1,6 mol = 3,4 mol
—> 3,4 mol / 2 L = 1,7 mol/L
Ethylethanoat: 1,6 mol
—> 1,6 mo / 2 L = 0,8 mol/L
Wasser: 1,6 mol
—> 1,6 mol / 2 L = 0,8 mol/L
Jetzt noch einsetzen:
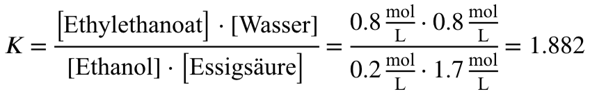
Damit hast du K bzw. Kc für die Reaktion ausgerechnet. Was sagt dir das jetzt?
Wenn K < 1 ist, muss der Nenner größer sein als der Zähler, du hast also mehr Edukt als Produkt vorliegen, dein Gleichgewicht liegt also auf der Eduktseite.
Wenn K = 1 ist, müssen Zähler und Nenner gleich groß sein liegt genausoviel Edukt wie Produkt vor.
Wenn K > 1 ist, muss der Zähler größer sein als der Nenner, du hast also mehr Produkt als Edukt vorliegen, dein Gleichgewicht liegt auf der Produktseite.
In deinem Beispiel hast du jetzt berechnet, dass das Gleichgewicht deiner Reaktion bei einem Kc von 1,882 auf Seite der Produkte liegt, du also mehr Produkt als Edukt vorliegen hast.