Elektronenkonfiguration von Molybdän aus dem PSE ablesen?
Ich dachte ich wär ein schlauer Fuchs und könnte aus dem PSE die Elektronenkonfiguration ablesen:
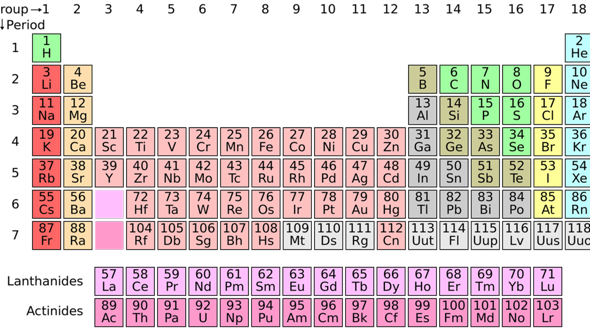
Undszwar hab ich mir gedacht, oben in der ersten Zeile steht 1s^1 (H) und 1s² (He).
Dann in der zweiten Zeile käme 2s1 (Li), 2s² (Be), 2p1 (B), 2p² (C), 2p³ (N) 2d4 (O), 2d5 (F), 2d6 (Ne).
In der 3. Zeile dann 3s1 (Na), 3s2 (Mg), ..... 3p6 (Arg)
und in der 4. Zeile dann 4s1 (K), 4s² (Ca), 3d1 (Sc), 3d² (Ti), 3d³ (V) usw.
Das ging auch all die Male gut, bis ich die Elektronenkonfiguration von Molybdän bestimmen sollte.
Molybdän hat die Nummer 42.
Wir gehen also von Krypton (36) aus und gehen an Rb mit 5s1 und Sr mit 5s² vorbei.
Dann noch an Y mit 4d1, Zr 4d², Nb 4d³ und dann käm Molybdän mit 4d^4. Also der Logik nach wäre die Konfiguration dann [Kr] 4d^4 5s^2.
Wäre jetzt meine Überlegung. Allerdings ist die Elektronenkonfiguraiton von Mo nicht [Kr] 4d^4 5s², sondern [Kr] 4d^1 und 5s^1.
Avec les gruesses freundlicheé,
Jensek81
Wo liegt mein Fehlerchen?
1 Antwort
Allerdings ist die Elektronenkonfiguraiton von Mo nicht [Kr] 4d^4 5s², sondern [Kr] 4d^1 und 5s^1
DIe Elektronenkonfiguration von Mo ist [Kr] 4d5 5s1.
Wo liegt mein Fehlerchen?
Tja, das ist das Bittere in der Chemie: Du hast keinen Fehler gemacht; deine Argumentation ist logisch und korrekt. Dir fehlten schlicht Informationen.
Der Grund, warum Mo hier aus der "erwartbaren" Reihenfolge ausschert, ist der Folgende: Manche Orbitalbesetzungen sind stabiler als andere. Das 4d-Energieniveau liegt an sich energetisch etwas höher als das 5s-Energieniveau; man sollte also davon ausgehen, dass 5s zuerst besetzt wird.
Aber, jedoch, allerdings: Im Falle von Molybdän (und Chrom) liegt ein Spezialfall vor, denn das halb gefüllte d-Niveau (d.h. d5) ist energetisch besonders günstig. Außerdem sorgt die d5-s1-Konfiguration dafür, dass das s-Orbital nur einfach besetzt ist, was - man denke an die Hundsche Regel - ebenfalls günstiger ist als ein doppelt besetztes Orbital.
Es gibt noch ein paar Elemente, die aus ähnlichen Gründen aus der Reihe tanzen, etwa Kupfer, Silber und Gold, die eine d10-s1-Konfiguration haben (und Gold noch f14). Grund dafür ist die besondere Stabilität des komplett gefüllten d-Niveaus, und abermals das günstigerweise halb besetzte s-Orbital.