Warum ist das so bei der Elektronenkonfiguration?
Wenn man Beispielsweise Gallium hat dann ist ja die Elektronenkonfiguration:
Was ich jetzt nicht verstehe ist warum es 3d ist und nicht 4d. Steht das nicht eigentlich in der vierten Zeile des Periodensystems?
2 Antworten
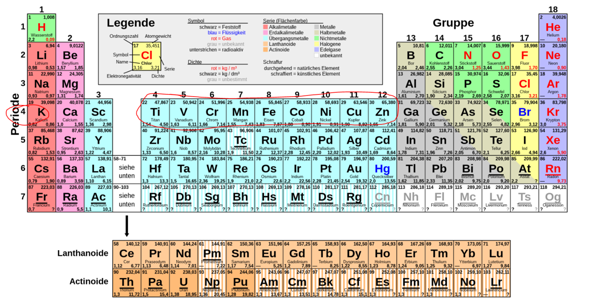
Die vierte Zeile des Periodensystems ist die vierte Periode.
Heißt ja schließlich Periodensystem und nicht Zeilensystem ;-)
Ein Periode beginnt, wenn mit dem Befüllen einer neuen Schale angefangen wird. Das heißt nicht, dass die Schale auch innerhalb der Periode vollständig befüllt wird. M.a.W. sind Periode und Schale recht verschiedene Dinge.
Konkret wird in der 4. Periode zuerst die vierte Schale befüllt, bei Kalium und Calcium, genauer die 4s-Unterschale. Dannach kommen erst mal die in der 3. Periode vergessenen Elektronen der 3. Schale dran, bei Scandium bis Zink, konkret die 4d-Unterschale, die 10 Elektronen fasst. Anomalien bei Chrom und Kupfer musst du nicht kennen. Nach dem Zink, also beim Gallium, wird die 4. Schale weiter befüllt, konkret die 4p-Unterschale, die 6 Elektronen fasst.
Das Schema nennt sich Madelung-Schema oder Aufbauprizig. Und weil es nicht ganz so einfach ist gibt es, wie oben angedeutet, auch noch Abweichungen, die man aber nicht alle kennen muss.
Das hat etwas mit den Energieniveaus in den verschiedenen Orbitalen zu tun, wenn vermeintlich "höhere Orbitale" (hier "4s") bereits befüllt werden bevor "niedrigere" voll sind (hier "3d").
Schau Dir die 10 türkis gezeichneten Elemente Sc (Scandium) bis Zn (Zink) und das Kalzium (Ca) davor an. Aus energetischen Gründen werden nach Kalzium (das schon zwei Elektronen im 4s Orbital hat) die 3d Orbitale aufgefüllt bevor es mit 4p1 weiter geht. Und so ein Einschub passiert auch nochmal bei den Lantanoiden und Actinoiden.