[Chemie] Schmelz- und Siedepunkte von Kohlenwasserstoffen?
Guten Tag,
ich benötige noch ein bisschen Hilfe, um die unterschiedlichen Schmelz- und Siedepunkte von Kohlenwasserstoffen zu verstehen. Ich freue mich auf eure hilfreichen Antworten.

Alkohole können untereinander durch ihre OH-Gruppen Wasserstoffbrücken ausbilden und haben daher höhere Schmelz- und Siedepunkte als vergleichbare Alkane. Je mehr Alkoholgruppen es gibt, desto höher sind Schmelz- und Siedepunkt. Daher ist zwar Ethan bei Raumtemperatur gasförmig, Ethanol (der Trinkalkohol) aber bei Raumtemperatur flüssig.
- Wieso können Alkohole durch ihre OH-Gruppen Wasserstoffbrückenbindungen ausbilden?
- Denn es befindet sich bei der OH-Bindung ja auch der Wasserstoff (H) außen, genau wie bei den anderen H-Atomen, die mit den C-Atomen gebunden sind (siehe Bild oben)
- Wieso können bei den H-Atomen, die mit den C-Atomen gebunden sind, nur Van der Waals Kräfte zu anderen gleichen H-Atomen entstehen (Beispiel: mehrere Propanol-Moleküle)?
- Wieso können bei den C-OH Bindungen Wasserstoffbrückenbindungen zwischen den H-Atomen entstehen (Beispiel: mehrere Propanol-Moleküle)?

Was hast du denn bisher über H-Brücken verstanden und was ist dir unklar?
Ich weiß, dass es bei Wasser (H2O) Wasserstoffbrückenbindungen gibt
4 Antworten
Eine H-Brücke geht nicht von H-Atom zu H-Atom! Sondern vom O-Atom des einen Moleküls zum H-Atom des anderen Moleküls.
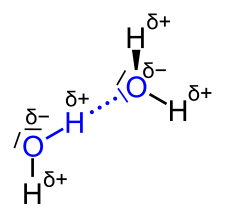
H-Brücken kommen dadurch zustande, dass ein freies Elektronenpaar (doppelt besetztes Orbital) eines partiell negativ geladenen Atoms (Elektronenüberschuss!) "ausklappt" und sich einem partiell positiv geladenen (Elektronenmangel!) H-Atom annähert. Quasi so, als würde eine neue Bindung entstehen und die beiden Bindungselektronen sind das freie Elektronenpaar. Betrachte zur Veranschaulichung dieses Bild:

Dafür brauchst du erstens eben dieses freie Elektronenpaar und den Elektronenüberschuss. Das ist meistens ein polar gebundes O-Atom, welches ja bekanntlich zwei freie Elektronenpaare hat. Alternativ könnte es z.B. auch ein N-Atom sein, das hat ja auch ein freies Elektronenpaar.
Und zweitens muss das H-Atom, zu dem das Elektronenpaar wandern soll, zwingend eine positive Partialladung tragen. Sonst zieht es die Elektronen logischerweise nicht an.
Du hast dir bei deiner Skizze selbst ein Bein gestellt, indem du die freien Elektronenpaare an den O-Atomen nicht eingezeichnet hast ;) Und du hast offenbar auch vergessen, dass das H-Atom nicht in einer Linie mit dem C- und dem O-Atom ist, wie man das auf zweidimensionalem Papier gerne zeichnet. Sondern auch die beiden Bindungen und die beiden freien Elektronenpaare am O bilden einen Tetraeder, wie man ihn schon von den 4 Bindungen am C-Atom kennt. Es kann sich also problemlos ein Elektronenpaar eines O-Atoms an das Hydroxy-H eines Nachbarmoleküls annähern, ohne mit seinem eigenen Hydroxy-H zu kollidieren.
Deshalb können Alkohole H-Brücken ausbilden, so wie Wasser.
Da die CH-Bindung unpolar ist, sind die betreffenden H-Atome nicht partiell positiv geladen. Also können sie keine H-Brücken eingehen. Außerdem hat so ein CH-Rest keine freien Elektronenpaare, die eine Brücke bilden könnten. Also bleiben hier nur die popeligen VdW-Kräfte.
Die Fähigkeit von Alkoholen, Wasserstoffbrückenbindungen über ihre OH-Gruppen auszubilden, beruht auf der besonderen Elektronegativität und Polarität der O-H-Bindung. Hier sind die Antworten zu deinen Fragen im Detail:
1. Wieso können Alkohole durch ihre OH-Gruppen Wasserstoffbrückenbindungen ausbilden?Die Bildung von Wasserstoffbrückenbindungen bei Alkoholen hängt davon ab, dass die O-H-Bindung stark polar ist:
- Sauerstoff (O) ist ein stark elektronegatives Element und zieht die Elektronen der Bindung stärker zu sich hin.
- Dadurch entsteht ein negativer Partialladungsschwerpunkt (δ⁻) am Sauerstoffatom und eine positive Partialladung (δ⁺) am gebundenen Wasserstoffatom.
Die partiell positiven Wasserstoffatome (δ⁺) können nun mit den partiell negativen Sauerstoffatomen (δ⁻) anderer Alkohol-Moleküle Wechselwirkungen eingehen, was zu Wasserstoffbrückenbindungen führt.
2. Warum entstehen bei den H-Atomen, die mit den C-Atomen gebunden sind, nur Van-der-Waals-Kräfte?Die C-H-Bindung ist nahezu unpolar, weil Kohlenstoff (C) und Wasserstoff (H) eine sehr ähnliche Elektronegativität haben. Das bedeutet:
- Es gibt keine große ausgeprägte Ladungsverschiebung zwischen C und H.
- Daher bilden sich keine großen Partialladungen (δ⁺ oder δ⁻), die Voraussetzung für Wasserstoffbrückenbindungen wären.
- Stattdessen wirken nur Van-der-Waals-Kräfte zwischen den unpolaren C-H-Bindungen. Diese Kräfte entstehen aus temporären Schwankungen in der Elektronenverteilung und sind viel schwächer als Wasserstoffbrückenbindungen.
In der C-OH-Bindung ist der entscheidende Punkt die Polarisierung der O-H-Bindung:
- Sauerstoff zieht aufgrund seiner hohen Elektronegativität die Elektronen der Bindung stärker zu sich.
- Dadurch ist das H-Atom in der OH-Gruppe partiell positiv geladen (δ⁺), und das O-Atom besitzt eine partielle negative Ladung (δ⁻).
- Das partiell positive H-Atom der einen OH-Gruppe kann mit dem partiell negativen O-Atom einer benachbarten OH-Gruppe eine Wasserstoffbrückenbindung ausbilden.
Diese Wasserstoffbrückenbindungen sind deutlich stärker als Van-der-Waals-Kräfte und erklären, warum Alkohole höhere Schmelz- und Siedepunkte haben als vergleichbare Alkane.
Zusammenfassung:
- O-H-Bindung: polar → Partialladungen → Wasserstoffbrücken möglich.
- C-H-Bindung: unpolar → keine Partialladungen → nur Van-der-Waals-Kräfte.
- Alkohole können Wasserstoffbrücken ausbilden, weil das H-Atom in der OH-Gruppe partiell positiv und das O-Atom partiell negativ geladen ist.
Du hast die Wasserstoffbrücken falsch gemalt. Schau mal hier
https://de.wikipedia.org/wiki/Wasserstoffbr%C3%BCckenbindung#/media/Datei:H-Bruecke-delta.svg
und ersetze die beiden nach unten zeigenden Wasserstoffatome durch den Alkylrest. In deinem Fall Propyl (weil 3C-Atome). Bildlich gesprochen ersetzt du ein H von Wasser durch Propyl,
H-O-H
Prop-O-H
Deiner Fragen sind dann recht einfach: Wasserstoffbrücken können nur entstehen, wenn auch Ein Sauerstoffatom mit im Molekül ist. An diesen kann eine Wasserstoffbrücke entstehen, am Rest nur vdW-Kräfte wirken.
Bei Propan ist das nicht der Fall, also gibt es hier nur die vdW-Kräfte.
m.f.G.
anwesende
Absolut richtig, aber im Moment für die Fragestellung nicht relevant und im ungünstigsten Fall sogar verwirrend. In einigen Bundesländern ist es sogar nicht mehr im Lehrplan enthalten, aber du hast vollkommen recht.
Ich habe mir gerade auch nochmal Videos dazu angesehen und verstehe es jetzt schon viel besser.
Bei den Alkanen wie Propan ist ja die Differenz der Elektronegativitäten zwischen Kohlenstoff (C) und Wasserstoff (H) so klein, dass es sich um eine unpolare Elektronenoaarbindung handelt.
Dennoch kommt es zufällig zu ungleichen Verteilungen der Elektronen, was einen temporären Dipol auslöst. Und dieser temporäre Dipol löst dann einen induzierten Dipol beim anderen Molekül aus. -> Van der Waals Kräfte
Bei Wasser ist die Differenz der Elektronegativitäten zwischen Sauerstoff (O) und Wasserstoff (H) so groß, dass es sich um eine polare Elektronenparbindung handelt. Die Elektronen werden eher zum Sauerstoff (elektronegativer als Wasserstoff) gezogen (negative Partialladung am Sauerstoffatom und positive Partialladungen an den Wasserstoffatomen). -> Wasserstoffbrückenbindungen zwischen H und O verschiedener H2O Moleküle.
Wasserstoffbrücken können nur entstehen, wenn auch Ein Sauerstoffatom mit im Molekül ist.
Das ist doch auch bei anderen stark elektronegativeren Atomen so und nicht nur bei Sauerstoff
An deinem Propanol fehlen die C-C-Bindungen.
Eine Wasserstoffbrückenbindung benötigt
1. einen POLAR gebundenen Wasserstoff (z.B. O-H, N-H, F-H ) und
2. ein freies Elektronenpaar beim Bindungspartner, wo das H binden kann.
3. Das H, welches die Bindung bewerkstelligt geht schnell als H+ vom einen zum anderen Molekül
C-H Bindungen sind unpolar. Polare X-H Bindungen benötigen eine große EN-Differenz.
Die C-C- Bindungen beim Propanol habe ich vorhin in der Schnelle vergessen. Vielen Dank für deine hilfreiche Antwort 🙏
Oh, zum Glück geht eine H-Brücke auch mit dem freien Elektronenpaar eines Stickstoffatoms. Sonst hätte die Biochemie ernste Probleme ;)