Was passiert mit Wasser, was sich beim gefrieren nicht ausdehnen kann?
Falls es gefriert…
8 Antworten
Wenn der Behälter stark genug ist und nicht bricht, dann gefriert ein kleiner Teil des Wassers, dehnt sich dabei aus und treibt den Druck so weit in die Höhe, daß der Rest des Wassers nicht mehr gefrieren kann. Man erhält also eine stabile Wasser/Eis-Mischung, die je nach Temperatur einen bestimmten Druck annimmt, der genau einem Punkt der Schmelzkurve entspricht.
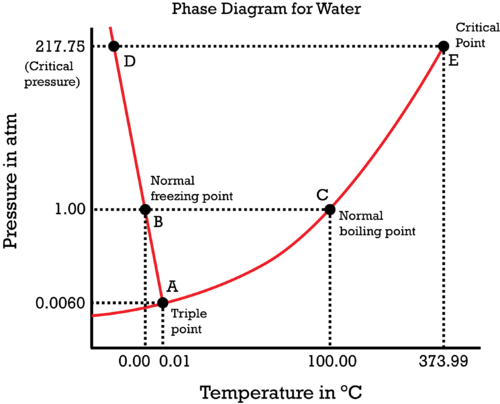
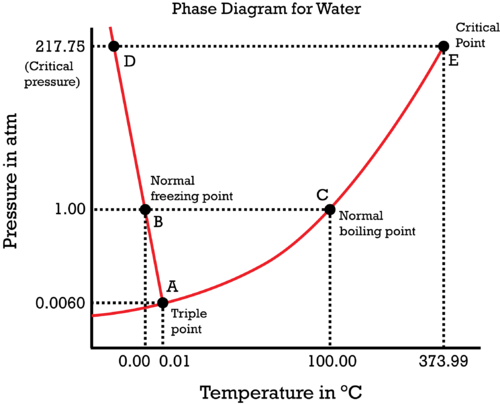
Durch das Abkühlen bewegt man sich also vom gewöhnlichen Schmelzpunkt B nach links oben, in Richtung D, und bleibt immer auf der roten Kurve. Du siehst, daß der Druck selbst bei sehr geringer Temperaturabsenkung stark ansteigt. Oberhalb des kritischen Punktes liegt kein flüssiges Wasser mehr vor, sondern dichtes superkritisches Gas, das sich unter diesen Bedingungen vermutlich weitgehend wie eine Flüssigkeit verhält. Wenn der Druck absurd groß wird, dann werden sich exotisches Eissorten bilden, die wesentlich dichter sind als gewöhnliches Eis, und das bremst den Druckanstieg irgendwann einmal wieder ein.
P.S.: Weil es in einer anderen Antwort etwas verwirrend steht, trage ich noch etwas nach. Der Behälter erreicht realistischerweise eine Temperatur von knapp (geschätzt ein paar Grad) unter Null und einen Druck von vielleicht ein paar hundert bar. Wenn Du ihn plötzlich öffnest (oder er zerbirst), dann fällt der Druck auf 1 bar, und unter diesen Bedingungen (Schmelzkurve) liegt der Schmelzpunkt bei 0 °C. Es wird also sofort flüssiges Wasser gefrieren, aber auf keinen Fall das ganze Volumen. Denn beim Gefrieren wird ja Wärme frei, die die Mischung wieder aufheizt. Daher gefriert genau so viel Wasser, daß die freiwerdende Schmelzwärme die Temperatur auf 0 °C hochtreibt. Du bist dann immer noch auf der Schmelzkurve, und zwar wieder am Punkt B.
Entweder schafft es sich Platz und zerstört somit den Behälter von dem es „festgehalten“ wird oder wenn der Behälter zu stark ist entsteht so ein enormer Druck wodurch wieder Wärme entsteht was dann die Kälte ausgleicht und es bleibt flüssig
Jain. Das Wasser bleibt flüssig, aber nicht weil Wärme entsteht, sondern weil der Druck den Gefrierpunkt absenkt.
Bei hohen Drücken gibt es ganz andere Eistypen, die teilweise bis zu mehreren 100 °C stabil sind, plus wohlgemerkt.
Siehe z.B. https://quant.uni-graz.at/quant-module/phasendiagramme/29-phasendiagramme-artikel/27-artikel-3-neutronensterne beim Diagramm mit den 17 Eisphase.
Allerdings bin ich grad intellektuell etwas überfordert, welche Phasen entstehen, wenn du Wassser von 0 °C bei konstantem Volumen abkühlst. Teilweises Gefrieren erhöht ja erst mal den Druck, der Druck bestimmt dann die Phasen, ein Teufelskreis.
Wenn es sich nicht ausdehnen und den Behälter nicht zerstören kann, bleibt es in unterkühltem Zustand weiterhin flüssig.
Lässt der Druck nach (z.B. weil das Gefäß geöffnet wird) gefriert es schlagartig.
Kannst du gerne mal mit Mineralwasser in einer PET-Flasche ausprobieren.
Nun, Wasser auf dem mont Everest würde viel schneller kochen, weil weniger Luftdruck da ist.
Hier würde es später gefrieren
Das ist das Prinzip der flüssiggasstanker, da wird solange Gas Rein gepumpt, bis das Zeug flüssig wird.
Ebenso bei den Sauerstoffbehältern im krankenhaus