Warum haben Orbitale negative und positive Seiten?
Atomorbitale sind ja Raumstrukturen, in denen sich Elektronen mit einer bestimmten Wahrscheinlichkeit aufhalten. Elektronen sind negativ geladene Teilchen. Wie kommt es, dass alle Orbitale, ausgenommen das s-Orbital, negative und positive Bereiche aufweisen?
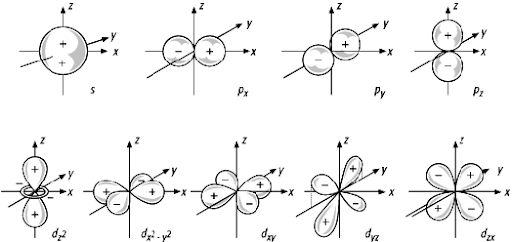
Bildquelle: GeoDZ
3 Antworten
das sind die Phasen der Wellenfunktion. Erst das Absolutquadrat der Wellenfunktion ist die Aufenthaltswahrscheinlichkeit.
Was bedeutet eine positive oder negative Phase der Wellenfunktion für das Orbital? Inwiefern unterscheiden sich die beiden Seiten des Orbitals?
Ich würde eher von einer Auffindungswahrscheinlichkeit sprechen, nämlich für den Fall, dass man das Elektron mit "Detektoren" unterhalb von Atomgröße zu lokalisieren suchte – wie auch immer man das realisieren mag, wenn das überhaupt gehen sollte.
Jedenfalls wäre das Elektron dann sofort nicht mehr in dem Energie- und Drehimpuls- Eigenzustand, in dem man es ja eigentlich beobachten wollte.
Hallo Lugano7,
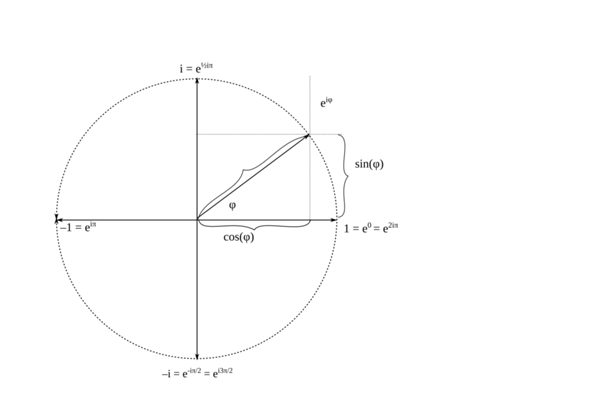
was da angebildet ist, ist grob gesprochen die Wellenfunktion ψ(r›, t), welche den Zustand des Teilchens beschreibt. Man muss dazu sagen, dass ψ(r›, t) eine komplexwertige Funktion des Ortes r› und der Zeit t ist, d.h., die Zahlenwerte der Funktion sind Zahlenwerte der Form
(1) z = x + iy = ⎜z⎟∙exp(iφ) = ⎜z⎟∙(cos(φ) + i∙sin(φ)),
wobei i die imaginäre Einheit ist, deren Quadrat −1 ist. Man kann i auch als Rotation einer Phase um 90° gegen den Uhrzeigersinn auffassen, wobei −1 als Rotation um 180° aufzufassen ist.
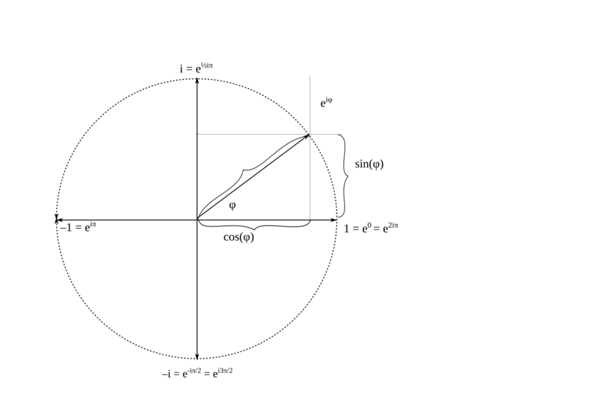
Abb. 1: Komplexe Zahlen
Stattdessen könnte man einen Vektor ⎜z⎟(cos(φ) | sin(φ)) definieren, das ist im Prinzip egal.
Entscheidend ist, dass es zwei Komponenten gibt und sich ⎜ψ⎟² als die Wahrscheinlichkeitsdichte dafür interpretieren lässt, ein Teilchen an einer Stelle zu lokalisieren.

Abb.2: Elektron im Atom. Die Farben stellen die Phase zu einem bestimmten Zeitpunkt dar. Würdest Du dies als Film sehen wie in der App 'Electron Orbitals', würden sich die Farben ändern, aber sie bleiben komplementär.

Für die Schulchemie/Physik sind die Vorzeichen nicht wichtig.
Die Vorzeichen stehen laut GeoDZ und laut meinem Wissen für die Vorzeichen der Wellenfunktion.
Die angegebenen Vorzeichen (+ oder -) beziehen sich auf das Vorzeichen der Wellenfunktion im betreffenden Bereich.
Das wiederrum ist Quantenphysik, und die wird meines Wissens nach in der Schule nur angeschnitten.