Titration berechnen?
Hallo, ich habe eine Aufgabenstellung und ich komme dort gar nicht vorran :(.
Ich würde mich über Tipps freuen
Titration: 20 mL einer 2,5 N Ammoniaklösung werden mit einer 5 N HCl titriert. Der pH-Wert wird mit dem pH-Meter verfolgt. Der pKB von Ammoniak beträgt 4,76.
a) Stellen Sie die Reaktiongleichung auf!
b) Welchen pH hat die Ammoniaklösung vor der Titration?
c) Nach welchem Volumen HCl wird der Pufferpunkt erreicht?
d) Welchen pH-Wert werden Sie am Pufferpunkt messen?
e) Nach welchem Volumen HCl wird der Äquivalenzpunkt erreicht?
f) Welcher pH herrscht rechnerisch am Äquivalenzpunkt?
g) Welcher pH-Wert wird nach Zugabe von 15 mL HCl gemessen?
h) Zeichnen Sie die Titrationskurve in ein Diagramm, bei dem die X-Achse dem verbrauchten Volumen HCl und die y-Achse dem pH-Wert entspricht.
1 Antwort
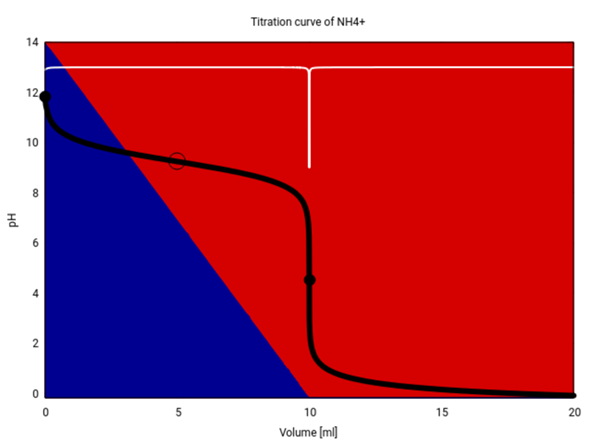
Das ist Deine Titrationskurve (schwarz) und die erste Ableitung davon (weiß). Die Hintergrundfarben codieren die Speziesverteilunng: Am Anfang liegt NH₃ (blau) von, im Lauf der Titration entsteht daraus die konjugierte Säure NH₄⁺ (rot):
NH₃ + HCl ⟶ NH₄⁺ + Cl¯
Zur Berechnung verwende ich den pKₐ-Wert des NH₄⁺, pKₐ=14−4.76 = 9.24
- Am Anfang der Titration liegt eine c=2.5 mol/l NH₃-Lösung vor, der pH läßt sich mit der Formel für schwache Basen berechnen, pH=7 + ½pKₐ + ½lg(c) = 11.82
- Halbzeit, also 5 ml.
- pH=pKₐ=9.24 (in der Graphik mit einem Ring gekennzeichnet)
- Die Stoffmenge NH₃ ist n=cV=2.5 mol/l ⋅ 20 ml = 50 mmol, daher brauchen wir ebensoviel HCl, also V = n/c = 50 mmol / (5 mol/l) = 10 ml.
- Am Äquivalenzpunkt liegt eine NH₄Cl-Lösung vor, und die Konzentration ist von den ursprünglichen 2.5 mol/l um den Faktor 20/(20+10) = ⅔ verdünnt, also c=1.67 mol/l. NH₄⁺ ist eine schwache Säure, also pH = ½(pKₐ−lg(c)) = 4.51 (schwarzer Punkt in der Graphik)
- Nach 15 ml haben wir 10 ml der HCl für die Neutralisation verbraucht und 5 ml Überschuß, diese 5 ml enthalten n=cV=25 mmol HCl, die in insgesamt 35 ml Suppe dahinschwimmen, die Konzentration ist also c=n/V=0.71 mol/l. Wir nehmen die Formel für starke Säuren: pH=−lg(c)=0.15
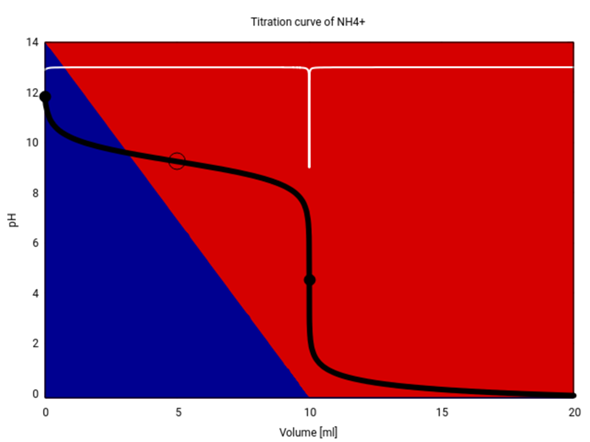
Er liegt idealisiert auf halbem Weg zum Äquivalenzpunkt. Bei schwachen Säuren/Basen ist das auch richtig, aber je stärker das Zeug wird, umso weniger kann man sich darauf verlassen.
Vielen dank für die Ausführliche Antwort, dass hilft mir wirklich sehr :)
Hi hätte da noch eine frage bzgl. c). Ich frage mich wieso der Pufferpunkt bei 5 mL liegt bzw. steht der Pufferpunkt im Zusammenhang mit dem Äquivalenzpunkt, dann müsste er doch der bei 10 mL liegen ?