SO2 Strukturformel
Wieso ist die SO2 Strukturformel so? (Foto)
Nach der Zeichnung hätte S ja nur 4 Valenzelektronen und O nur jeweils 2. Aber die haben doch beide 6. Wieso gibt's also nicht Doppelbindungen zwischen S und O und und am O jeweils noch 2 Striche und am S noch eine Strich?
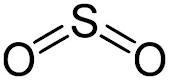
5 Antworten
Bei Strukturformeln ist es üblich, nur die an der Bindung beteiligten Elektronenpaare zu zeichnen.
Ausnahmen nur dann, wenn man auf die freien Elektronenpaare extra hinweisen möchte, beispielsweise, weil die für den nächsten Reaktionsschritt von Bedeutung sind.
O hat nur 2 Valenzelektronen da vier der eigenen schon miteinander Bindungen eigegangen sind.
Aufgrund des gemessenen Bindungswinkels von ca. 120° muss man sp2-hybridisierte Orbitale annehmen. Folglich verteilen sich die 9 Elektronenpaare wie folgt:
In der Molekülebene:
- 2 bindende Elektronenpaare
- 1 nichtbindendes Elektronenpaar am Schwefel
- je 2 nichtbindende Elektronenpaare an den Sauerstoffatomen
Senkrecht zur Molekülebene erstrecken sich 3 p-Orbitale, in denen die restlichen 2 Elektronenpaare delokalisiert sind. Die antibindende Überlagerung bleibt also leer:
- 1 vollständig delokalisiertes, bindendes Elektronenpaar
- 1 nichtbindendes Elektronenpaar an den Sauerstoffatomen
stimmt blicke ich nicht ganz durch.
Senkrecht zur Molekülebene erstrecken sich 3 p-Orbitale, in denen die restlichen 2 Elektronenpaare delokalisiert sind. Die antibindende Überlagerung bleibt also leer:
1 vollständig delokalisiertes, bindendes Elektronenpaar 1 nichtbindendes Elektronenpaar an den Sauerstoffatomen
Den Teil verstehe ich noch nicht...
Wenn man die Elektronenpaare zuordnet, wie in der Frage vorgeschlagen, so ist die Oktettregel am Schwefel verletzt. Die zwei Doppelbindungen charakterisieren das Molekül leider nur unzureichend. Genau genommen ist schon das gezeigte Foto als Ausgangspunkt falsch.
Der zweite Teil meiner Antwort beschreibt in der Sprache der LCAO die genaue Struktur der Doppelbindungsanteile. Das deckt sich im Wesentlichen damit, was botanicus als Mesomerie bezeichnet hat, allerdings ohne die Notwendigkeit, ein Zwitterion zu postulieren.
Fazit: Einfach nur Elektronenpaare hinzumalen, trifft den Charakter eines Moleküls manchmal haarscharf daneben.
Leider ist die Hlfreichste Antwort irreführend. Ein wenig voreilig vergeben, das Sternchen ...
SO2 ist ein mesomeriestabilisiertes Zwitterion, sonst müsste man eine Oktettüberschreitung postulieren. Es gibt kein freies Elektronenpaar am Schwefel, wenn er schon vier Bindungen hat. Das wurde früher so beschrieben, gilt aber mittlerweile als überholt.
Weder irreführend noch voreilig.
Ich bezweifle die Mesomeriestabilisierung nicht. Aber ich bezweifle, dass sie etwas mit der Frage zu tun hat.
Ich weiss nciht, wie Du auf die Idee kommst, im SO2 sei kein freies Elektronenpaar am Schwefel. Ist aber auch egal - die am Sauerstoff hast Du ja nciht in Frage gestellt. Und somit bleibt immer die Frage von keulehans weiterhin: Wieso werden diese in der Strukturformel des SO2 nicht durch zwei weitere Striche dargestellt?
Ich hab mich oben vertippt, Doppelbindungen gibt's ja doch ;) Aber wieso sind nicht noch jeweils 2 Striche neben den O´s und einer neben dem S?
Danke für Deine Recherche. Ich finde sie sehr informativ.
Ob allerdings der Fragesteller damit was anfangen kann? Das bezweifle ich.