Warum 1 Doppelbindung bei PO43-?
Hallo, ich habe mir eine PDF mit Übungsaufgaben zum Aufstellen chemischer Strukturformeln heruntergeladen und habe dazu eine Frage.
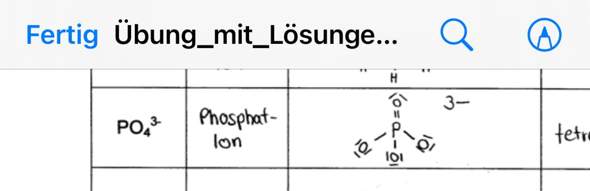
Für das Phosphat-Ion PO43- steht Phosphor P in der V. HG, besitzt also 5 Valenzelektronen und Sauerstoff O in der VI. HG, besitzt also 6 Valenzelektronen.
Ich habe die Summe der Valenzelektronen aller beteiligten Atome des Anions gebildet und bin auf 5(P)+4*6(O))+3 = 32 gekommen. Ich habe für die Strukturformel das P-Atom als Zentralatom bestimmt und die 4 O-Atome im 90 Grad Winkel durch eine Einfachbindung drum herum gruppiert, 8 von den 32 Valenzelektronen sind also schon weg und 24 Valenzelektronen müssen noch verteilt werden. Dann habe ich jeweils für die 4 O-Atome 6 Valenzelektronen ergänzt, womit die restlichen 24 Valenzelektronen vergeben sind. Das P-Atom hat 8 Valenzelektronen, also eine volle äußere Schale und erfüllt die Oktettregel. Die 4 O-Atome erfüllen auch jeweils die Oktettregel und haben 8 Valenzelektronen in der äußeren Schale. Die Edelgaskonfiguration wäre also erfüllt und alle Valenzelektronen so verteilt, dass alle Atome eine voll besetzte äußere Schale haben.
Schliesslich habe ich die Formalladung berechnet und bin für das P-Atom auf 4 Valenzelektronen gekommen, Phosphat P hat eigentlich 5 Valenzelektronen also -1 und somit eine Formalladung von +1. Die 4 O-Atome haben jeweils 7 Valenzelektronen, Sauerstoff O hat eigentlich aber 6 Valenzelektronen also +1 und somit eine Formalladung von -1. Wenn man die Formalladungen addiert, kommt man auf (4*(-1))+1 = -3 und somit passt das doch mit der Gesamtladung des Ions von -3?
Ich habe nun die Lösung gesehen und verstehe nicht, wieso in der Lösung 1 der 4 O-Atome durch eine Doppelbindung mit dem P-Atom verbunden ist, wodurch das O-Atom zwar immernoch 8 Valenzelektronen hat, also die Edelgaskonfiguration erfüllt, aber eine Formalladung von 0 hat.
Und das P-Atom hat aufeinmal 10 Valenzelektronen bzw. 5 Bindungen (3 Einfachbindungen, 1 Doppelbindung), geht sowas? Ich dachte, dass alle Atome, die die Oktettregel erfüllen müssen, nur max. 4 Bindungen haben dürfen? Das P-Atom hat außerdem dadurch eine Formalladung von 0. Wenn man die Formalladungen nun addiert, kommt man auf (3*(-1))+0+0 = -3 und somit passt das eig auch wieder mit der Gesamtladung des Ions von -3.
Meine Frage ist nun, warum die Doppelbindung an dieser Stelle notwendig ist, da die Formalladung in meiner Lösung ja mit der Gesamtladung des Atoms übereinstimmen würde und auch die Edelgaskonfiguration erfüllt gewesen wäre, also was war daran falsch?
Und ist es überhaupt möglich, dass ein Atom mehr als 4 Bindungen eingehen kann?

2 Antworten
Deine Lewisformel ist nicht wirklich falsch. Sie hat gegenüber der kanonischen (mit einer P=O-Doppelbindung) sogar einen halben Vorteil, dem aber zwei Nachteile gegenüberstehen:
- Deine Formel sagt richtig voraus, daß alle P–O-Bindungen gleich lang sind
- Allerdings sind die P–O-Bindungen im echten Phosphat kürzer als reine Einfachbindungen und Deine Formel kann das nicht erklären.
- Du brauchst Formalladungen, und die will man eigentlich nicht, wenn man es vermeiden kann
Atome ab der dritten Periode erweitern die Oktettregel dahingehend, daß sie mindestens acht Außenelektronen anstreben. Es gibt ja Verbindungenn wie PCl₅, SF₆ oder gar IF₇, die ganz klar zeigen, daß 8 Elektronen keine Grenze darstellen. Man spricht auch von „erweiterte Oktetten“ (Dezett, Dodezett etc.). Umgekehrt können diese Atome kaum noch Doppelbindungen untereinander ausbilden, sehr wohl aber solche zu O (auch N und C).
Daher ist es möglich, Deine Formel aufzufetten, indem man ein einsames Elektronenpaar an einem O zu einem bindenden umwidmet. Damit wird man die Formalladung los, bekommt aber das Problem, daß man eine PO-Bindung als Doppelbindung und die anderen als Einfachbindung anschreibt. Ein Naïver könnte das so lesen, daß es eine kurze und drei lange PO-Bindungen gäbe, und das wäre natürlich falsch.
Eine solche unsymmetrische Lewis-Formel muß man etwas anders lesen: Es lassen sich 4 verschiedene Strukturen anschreiben, die sich nur in der Lage der Doppelbindung unterscheiden. Die Struktur des realen PO₄³⁻ ist der Mittelwert von allen, also liegen vier 1¼-Bindunge zwischen P und O vor.
Nebenbei gesagt: Es gibt auch das Orthonitrat-Ion NO₄³⁻, und da Stickstoff keine erweiterten Oktette bilden kann, kann man die Strukturformel des NO₄³⁻ nur so aufschreiben wie Deine Version von PO₄³⁻, also mit Formalladungen. Ebenso ist es auch mit den Paaren NOF₃ und POF₃ bzw. O₃ und SO₂.
Die OktettRegel gilt nur streng in der 2. Periode. Es gibt PF5 und SF6, wo Phosphor und Schwefel 5 und 6 Bindungen eingehen, also 10 und 12 Außenelektronen besitzen.
Allerdings gilt für die 3. Periode die DoppelbindungsRegel. Diese Elemente können KEINE Doppelbindungen eingehen! Allerdings ist es trotzdem üblich die Oxide und SauerstoffSäuren von Phosphor und Schwefel mit Doppelbindungen darzustellen. Es ist vermutlich einfacher und etwas übersichtlicher, weil man sich die Formalladungen spart. Und legitim ist es, weil sie als theoretische mesomere Grenzstrukturen deklarieren kann.