NO3- Valenzstrichschreibweise - stimmt das so?
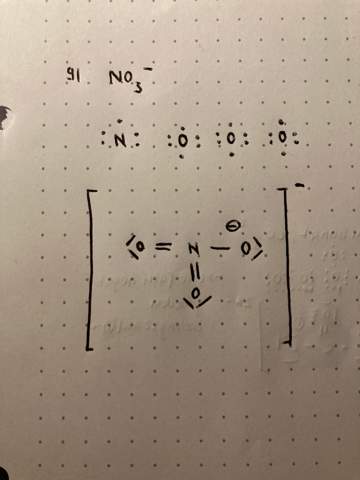
hallo ich hänge in Chemie bei dieser Aufgabe zur valenzstrichschreibweise. Kann mir jemand sagen ob das so stimmt oder was ich falsch gemacht habe? Vor allem verstehe ich nicht wie diese Formelladung zu verstehen ist also was ich damit mache.
2 Antworten
Ja, naja fast. Also die Winkel stimmen nicht. Das sind 60° jeweils. Außerdem hat dein Stickstoff 5 Bindungen, das ist eine zuviel. Du hast zwei einfach und einen doppelt gebundenen Sauerstoff. Und die einfach gebundenen O haben drei freie Elektronenpaare, nicht zwei wie bei dir, und tragen jeweils eine negative Ladung. Das N ist einfach positiv geladen. Sieht dann so aus:
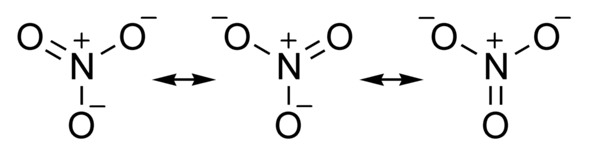
Ja, die sind alle gleichwertig. Die reale elektronische Struktur ist der Mittelwert zwischen den dreien sozusagen
Formalladung (mit a): die Bindungselektronen werden gleichmäßig auf die Bindungspartner aufgeteilt. Dann werden die Elektronen zu einem Atom gezählt und die Kernladung; die Differenz ist die Formalladung.
Rechts oben das O hat 5 Elektronen zugeordnet, hat demnach eine Formalladung von +1. Hier fehlt ein Elektronenpaar.
Ich würde sagen, bis auf dies hast du die Aufgabe so gut gelöst, wie es von einem Schüler zu erwarten ist.
-----
Wie so oft, sind die Dinge aber komplizierter, als man es in der Schule lernt: https://de.wikipedia.org/wiki/Nitrate#Struktur
So was könnte man erwarten, nachdem die Valenzstrichschreibweise "sitzt" und Dinge wie "Mesomerie" ("die Wahrheit liegt irgendwo dazwischen") eingeführt worden sind. Von daher halte ich die Aufgabe mit Nitrat für didaktisch unglücklich gewählt.
danke, das sind doch drei verschiedene Lösungmöglichkeiten, nennt man das dann Mesomerie?