N2O nach Lewis-Formel richtig gezeichnet?
Hey Leute. habe ich N2O, also Distickstoffmonoxid nach der Lewisformel richtig aufgezeichnet? Müsste doch richtig sein, N=3 Bindungen O=2 Bindungen
Bei google sehe ich immer andere Lösungen. Hoffe ihr könnt mir helfen.
lg
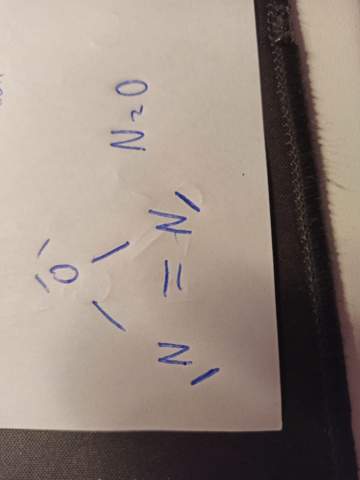
4 Antworten
Es gibt ein Argument, das rasch Zweifel an Deiner Struktur sät: N₂O ist isoelektronisch zu CO₂, die beiden haben also gleich viele Elektronen und sollten daher ähnlich aussehen. Deshalb erwartet man eine lineare Struktur, keine cyclische.
Tatsächlich kann man zwei mesomere Grenzstrukturen aufschreiben, N≡N–O und N=N=O (mit jeweils soviel einsamen Elektronenpaaren, daß die Oktettregel für jedes Atom erfüllt ist). Das echte Molekül ist eine Mishung von beidem, mit einer ungefähr zweenhalbfachen Bindung zwischen den Ns und einer einenhalbfachen N–O-Bindung.
Deine cyclische Struktur könnte als kurzlebiges Teilchen unter exotischen Bedingen vielleicht existieren, aber unter den untersten 6 Zuständen von N₂O konnte ich sie nicht finden, sie müßte also sehr energiereich sein oder gar nicht existieren.
Nicht immer, aber sehr oft. Bei so kleinen Verbindungen leichter Elemente fällt mir auf die Schnelle kein Gegenbeispiel ein, aber wenn man nur die valenzelektronen betrachtet und auch schwerere Elemente zuläßt, dann gibt es schon viele, manche offensichtlich (CO₂/SiO₂), manche subtiler (HOCN/HNCS, oder IF₃/ICl₃).
Nein. Das ist leider falsch. Ein N baut eine Doppelbindung mit dem anderem N auf und das andere eine Dopelbindung mit dem O.
Das ist aber nur eine Möglichkeit, da Lachgas ein mesomeres Molekül ist.
Die andere Möglichkeit wäre die Dreifachbindung zwischen den Ns und eine Einfachbindug zwischen dem einen N und dem O.
Schau dir die Theorie der Lewis-Formeln nochmal an, um die Bindungsanzahlen zu bestimmen.
also das heißt, dass die elektronenverteilung bei mir falsch ist? also es kann keine "korrekte" elektronenverteilung geben. es muss also immer etwas positiv und etwas negativ sein?
Nope, nach deiner Zeichnung müsste dann N2O zweifach positiv geladen sein, da dein Stickstoff vierbindig ist.
aber ein N beispielsweise unten links hat ja nur drei bindungen jeweils zum anderen N 2 Bindungen und nach oben zum O eins oder irre ich mich? danke für die antwort btw
Nö, das passt nicht, was Du da gezeichnet hast. Allein schon die RIngspannung wäre für das Molekül extrem ungünstig sein. Aber vielleicht ist ja EIN Stickstoffatom positiv und das Sauerstoffatom negativ geladen ;) wie könnte das dann aussehen?
hmm okay verstehe. letzte frage dann bin ik weg, ich sehe halt nicht genau wo ein N vierbindig könntest du das kurz erklären?
Sorry hatte mich verguckt, da ist nicht vierbindig - mein Fehler, sorry - Asche auf mein Haupt! Aber der andere Grund bleibt bestehen: Die RIngspannung wäre sehr ungünstig
ah hahahaha wollte schon sagen, alles gut. okay verstehe danke trotzdem
Der Tip mit positiv und negativ geladenen Atomen bleibt dennoch bestehen ;)
Hi,
grundsätzlich wäre ein solcher Aufbau möglich, aber dreigliedrige Ringe sind wegen der Ringspannung sehr selten. In Wirklichkeit ist N2O linear. Das ist aber nicht unbedingt Schülerwissen. Das kannst du kaum erraten. Deswegen: Kompliment für deinen schönen Versuch - auch wenn er nicht die Realität abbildet. Das Prinzip hast du verstanden. ;)
Wenn du bei Wikipedia nach Lachgas suchst, findest du die beiden möglichen Strukturformeln von N2O. Eine sieht so aus (ohne Ladungen gezeichnet) :
<N=N=O>
... und die andere bekomme ich mit meinem Handy nicht hingetippt. Schau die dir einfach bei Wikipedia an. FUNFACT: Wenn es wie hier zwei Möglichkeiten der Elektronenverteilung gibt, nennt man das Mesomerie.
LG
Ich finde die Idee mit den beiden freien ElektronenPaaren sehr elegant GG
jetzt so wie ich es verstanden hab, ist die spannung höher, je kleiner der winkel ist, bei dreigliedrigen ist der bindungswinkel also bei 60 grad ca und somit ist die ringspannung sehr hoch? wieso geht das nicht bei N2O es ist dreigliedrig und hat dann dementsprechend (nach meiner zeichnung) eine sehr hohe spannung. weswegen kann N2O nicht als ring vorkommen?
hey. danke für deine motivierende und erleuchtende antwort :D sicher dass das nicht abiturwissen oder so ist? ich wiederhole gerade chemie und nutze dazu einen duden für chemie und das wird drin erwähnt aber so richtig verständlich wird es nicht erklärt.
also wenn eine verbindung isoelektronisch zu einer anderen verbindung ist, sieht sie IMMER ungefähr so ähnlich aus?