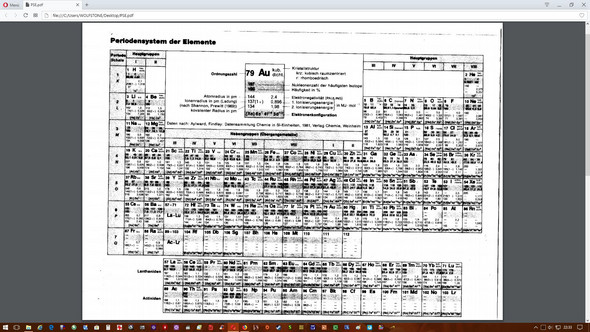
Kann mir einer Sagen wo man bei diesem PSE die Atommasse ablesen kann?
Ich schreibe die Tage eine Chemie-Klausur und der Lehrer wird uns genau dieses PSE aushändigen.
Kann mir einer sagen wo ich in diesem PSE die Atommasse ablesen kann?
Ich persönlich finde dieses PSE unübersichtlich :(
5 Antworten
Die Atommasse ist die Massezahl, in dem Fall wird sie als Nukleonenzahl bezeichnet.
Die Masse des jeweiligen Atoms in kg ist dann annähernd gegen durch: Nukleonenzahl * 1.66*10^-27kg
Die 1.66*10^-27 sind btw die Atomare Masseneinheit welche definiert ist als ein 12tel der Masse des C12 Atoms.
Die Molare Masse ergibt sich einfach durch Nukleonenzahl g/mol
Absurderweise scheint die wirklich nicht draufzustehen. Für Chemiker, die irgendwelche stöchiometrischen Aufgaben lösen wollen, ist das Ding also wertlos.
Näherungsweise kannst Du die molare Masse durch Mittelung über die Massenzahlen berechnen. Für Chlor wäre das dann z.B. (wenn ich das richtig lese, ist auf dem Scan kaum zu erkennen) 35·0.757 + 37·0.242 = 35.45. Das ist aber nicht wirklich 100%ig genau, erstens weil die Massenzahlen nicht genau den Massen der Atome entsprechen (wegen unterschiedlicher Masse von Protonen und Neutronen und wegen des Massendefekts), und zweitens weil Du ja nur maximal drei Isotope und ihre Häufigkeiten angegeben hast und das nicht für alle Elemente reicht.
Zinn hat z.B. zehn natürliche Isotope, und Dein komisches Periodensystem gibt Dir nur die drei häufigsten an: Daraus kannst Du zwar einen Mittelwert bilden:
M ≈ ( 116 · 0.146 + 118 · 0.24 + 120 · 0.326 ) / ( 0.146 + 0.24 + 0.326) = 118.50
aber der richtige Wert ist 118.71. Das ist jetzt zwar nicht desaströs falsch, aber Maßanalyse solltest Du mit diesen „Atommassen“ besser nicht betreiben.
APITA.
Die Molare Masse ist dort als "Nukleonenzahl" beschrieben
Dort sind allerdings die häufigsten Isotopen einzeln aufgeführt mit natürlichem Vorkommen.
Die durchschnittliche Atommasse erhält man wenn man die Atommassen aufgrund deren natürlicher Häufigkeit in Verhältniss setzt und den Durchschnitt errechnet.
z.B. rechnerisches Beispiel zum Vorgehen (Zahlen erfunden)
Isotpop 1/ 75% Vorkommen, Molare Masse: 22 g/mol
Isotop 2/ 25% Vorkommen, Molare Masse: 24 g/mol
Molare Masse: 22,5 g/mol
Aus ihr lässt sich die Atommasse errechnen, sie wird meist im Vergleich zu der eines Wasserstoffatom ins Verhältniss gesetzt mit der Dimensionslosen Einheit u.
*kein Wasserstoff, sondern 1/12 der Masse von C12 (wie PeterKremsner schrieb)
Gar nicht. Du kannst da nur die "atomare Masse" rauslesen (vielleicht meinst du ja das). Ansonsten hilft da wohl nur auswendig lernen. Du könntest sie mit den angegebenen Daten ausrechnen, aber das wäre etwas gemein.
So wie es aussieht gar nicht. Was habt ihr denn für ein Thema?