In 500ml einer Lösung sind 10g Essigsäure und 15g Natriumacetat gelöst. Um wieviel pH-Stufen verändert sich der pH-wert bei Zugabe von 2g NaOH-Pulver?
Hallo, ich bräuchte Hilfe wie ich diese Aufgabe berechnen kann. Ich habe schon den pH-Wert vor 4,3 raus bin mir aber nicht sicher ob das stimmt kann mir jemand helfen? LG
2 Antworten
Die molaren Massen von Essigsäure und (kristallwasserfreiem) Natriumacetat sind 60 bzw. 82 g/mol, also setzt Du n=m/M=0.167 mol Essigsäure und 0.183 mol Acetat ein; da eine Mischung aus Säure und konjugierter Base vorliegt, haben wir es mit einem Puffer zu tun.
Das alles lebt in einem halben Liter Lösung, daher sind die Konzentrationen doppelt so groß wie die Stoffmengen, aber die brauchen wir nicht wirklich, weil das Lösungsvolumen auf den pH kaum Auswirkungen hat und wir daher direkt mit den Stoffmengen in die Henderson–Hasselbalch-Gleichung gehen können:
pH = pKₐ + lg(Acetat/Essigsäure) = 4.79 (ich habe den Standardwert pKₐ=4.75 für Essigsäure verwendet).
Nun fügst Du 2 g NaOH bzw. n=m/M=0.05 mol NaOH hinzu. Dadurch vermindert sich die Stoffmenge an Essigsäure um 0.05 mol, und die des Acetats steigt entsprechend. Es resultiert ein pH von 5.05.
Als Bonus rechne ich das noch für allgemeiner NaOH-Menge zu. Du siehst, daß die Lösung ihren pH bis Zugabe von etwa 5 g NaOH gut halten kann, aber wenn alle Essigsäure verbraucht ist (roter Hintergrund verschwindet), dann bricht der Puffer vollmommen zusammen; das ist bei 6.6 g NaOH der Fall, weil dann die Stoffmenge der NaOH gleich groß ist wie die der Essigsäure.
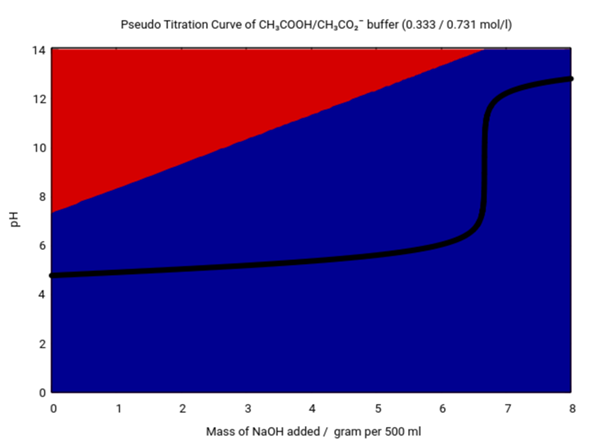
Das NaOH "verwandelt" Essigsäure in Acetat:
OH(-) + HAc => H2O + Ac(-)
Man muss zuerst die drei Stoffmengen ausrechnen:
Vorher:
n(HAc) = 10g : 88g/mol = 0,11 mol
n(NaAc) = 15g : 110g/mol = 0,14 mol
n(NaOH) = 2g : 40g/mol = 0,05 mol
Gemäß der Reaktionsgleichung wird Acetat um 0,05 mol mehr, während HAc um 0,05 mol weniger wird:
Nachher:
n(HAc) = 0,11 - 0,05 = 0,06 mol
n(Ac) = 0,14 + 0,05 = 0,19 mol
Diese beiden Werte kommen nun in die Henderson-Hasselbalch-Gleichung:
pH = pKs + log ([HAc]/[Ac])
pH = 4,75 + log (0,06 / 0,19)
pH = 4,25
(Das Volumen darf man ignorieren, weil es sich in der Henderson-Hasselbalch-Gleichung rauskürzt.)
Alles klar?
Wie kommst Du auf die molare Masse 88 g/mol für Essigsäure?
Das ist nicht meine Rechnung gewesen ich bin da auch auf 82 g/mol gekommen
Ups, ähm. Da habe ich mich vertan. Dann stimmt die Molmasse von Natriumacetat natürlich auch nicht. Keine Ahnung, was da gerade in meinem Kopf vorging. 🤔😅
Ich danke dir vielmals!!! Ich habe da ein paar Fehler gemacht aber sonst kann ich das nachvollziehen danke nochmals!!! :)