Pufferlösungen?
Hallo!
Ich verstehe diesen Eintrag im Skript nicht. Es geht darum zu sehen ob sich der pH einer Essigsäure-Lösung ändert, wenn Natriumacetat hinzugegeben wird, also die konjugierte Base.
In der Vorlesung meinte der Dozent, dass die Gleichgewichte in den beiden Reaktionen weit links liegen, was in meinen Augen keinen Sinn macht, da Natriumacetat doch eigentlich fast vollständig in seine Ionen dissoziiert in einer Lösung.
Weiterhin hieß es, dass durch die Erhöhung der Acetat Konzentration, die Wasserstoffionen sofort wieder gebunden werden und sich der pH somit nicht ändert? Aber warum bindet nicht einfach das schon zuvor entstandene Acetat von der Essigsäure nicht die H+? Warum ist es gut wenn mehr Acetat vorhanden ist? Und ändert sich der pH Wert denn jetzt eigentlich durch die Zugabe von Natriumacetat oder nicht?
Und nach diesem Ausschnitt heißt es weiter, dass sich der pH ändert?? Also alles sehr verwirrend in meinen Augen.
Ich denke ich habe vielleicht einfach das grundlegende Konzept nicht verstanden bzw. missverstanden :(
Kann mir jemand bitte weiterhelfen?
2 Antworten
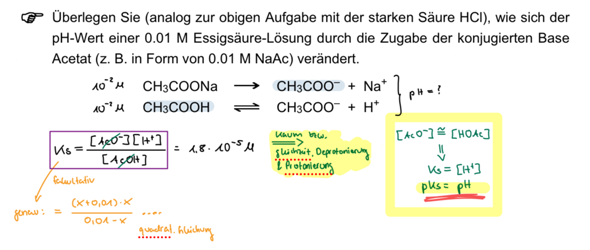
Du willst also zu einem Liter 0.01 mol/l Essigsäure Natriumacetat dazulöffeln und herausfinden, was der pH-Wert macht:
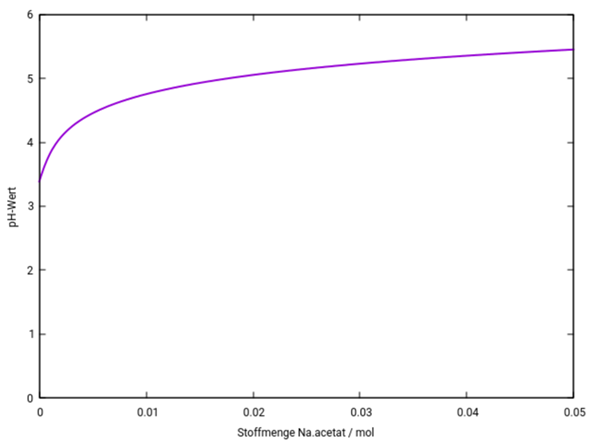
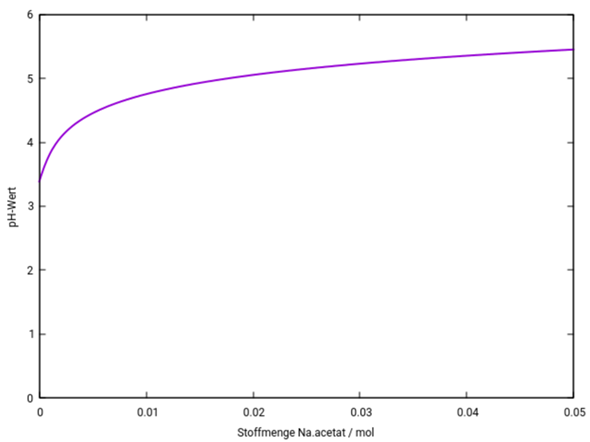
Die Essigsäure hat den pH=½(pKₐ−lg(c)) = 3.38, und bei Acetatzugabe steigt das zuerst einmal stark an, bis genug Acetat zur Pufferbildung in der Suppe ist; dann bleibt der pH im Bereich des pKₐ, also bei ungefähr 4.75. Eine reine Acetatlösung hätte pH=7+½pKₐ+½lg(c), für c=0.05 mol/l wären das pH=8.72. Du siehst, daß dieser pH bei weitem nicht erreicht wird; stattdessen stecken wir am Ende der Graphik bei 5.45 fest. Selbst bei Zugabe von 0.5 mol Acetat wären es nur pH=6.45, bei bei 5 mol entsprechend pH=7.45.
Essigsäure ist nur schwach dissoziiert; gibst du weitere Acetationen dazu, werden die entstandenen Protonen (Oxoniumionen) bis zu eben diesem Anteil ebenfalls gebunden, der pH nimmt zu.
Betrachte den Massenwirkungsquotienten dazu: Damit dessen Wert/die Konstante gleich bleiben kann, müssen bei steigender c(Ac-) die c(H+) abnehmen.