Hilfe bei Reaktionsbedingungen?
Kann mir jemand das hier erkläre und wie man hier auf eine Antwort kommt?
3 Antworten
Moin,
du hast es mit folgendem Reaktionsschema zu tun:
ΔH0 +Q // 3 H2 + N2 ⇌ 2 NH3 // ΔH0 –Q
(Haber-Bosch-Verfahren zur Herstellung von Ammoniak)
An dem Schema kannst du mehreres erkennen: Es gibt eine Hinreaktion:
3 H2 + N2 → 2 NH3
Diese Hinreaktion verläuft exotherm (sie setzt Energie frei; –Q).
Und es gibt eine Rückreaktion:
2 NH3 → 3 H2 + N2
Die Rückreaktion ist dementsprechend endotherm (+Q).
Außerdem verringert sich bei der Hinreaktion das Volumen, weil anfangs vier Teilchen vorhanden sind (3 H2 + 1 N2) und am Ende nur noch zwei (2 NH3).
Nach dem Prinzip des kleinsten Zwangs (LeChatelier) wäre es also für eine große Ausbeute an Ammoniak (NH3) günstig, wenn man die Reaktion bei möglichst niedrigen Temperaturen und großem Druck ablaufen lassen würde. Warum?
Nun: Da die gewünschte Reaktionsrichtung (die Hinreaktion) exotherm verläuft, wäre es nicht gut, wenn die Temperatur während der Reaktion hoch ist, weil dann zu der hohen Temperatur ja noch die Energiemenge aus dem exothermen Vorgang dazu käme. Eine hohe Temperatur begünstigt also die Reaktionsrichtung, die Energie benötigt, mit anderen Worten die Rückreaktion. Deshalb wäre eine möglichst geringe Umgebungstemperatur wünschenswert.
Beim steigenden Druck ist es so, dass die Seite begünstigt wird, die weniger Teilchen aufweist, weil weniger Teilchen bei hohem Druck besser Platz finden als viele. Darum sollte der Druck für die erwünschte Reaktionsrichtung möglichst groß sein.
So weit, so gut!
Doch jetzt kommen die großen Abers...
Ein Problem ist, dass Stickstoff (N2) relativ reaktionsträge ist. Das bedeutet, dass es nicht so leicht ist, ihn überhaupt zur Reaktion mit anderen Stoffen zu bewegen. Damit das gelingt, braucht man relativ hohe Temperaturen (Aktivierungsenergie). Aber das ist ungünstig für die exotherm ablaufende Reaktion.
Ein weiteres Problem mit der Temperatur ist, das für die Herstellung von Ammoniak aus den Elementen vier Teilchen dazu gebracht werden müssen, mit genügend Geschwindigkeit und im richtigen Winkel zusammenzustoßen, damit sie dann zu Ammoniakmolekülen werden können. Tja, und für die Geschwindigkeit und zur Erhöhung der Wahrscheinlichkeit, dass die vier Teilchen im richtigen Winkel aufeinander treffen, braucht man... ja! Dazu braucht man genügend Energie, also wieder eine hohe Temperatur. Auch das ist natürlich schlecht für den Ablauf einer exothermen Reaktion.
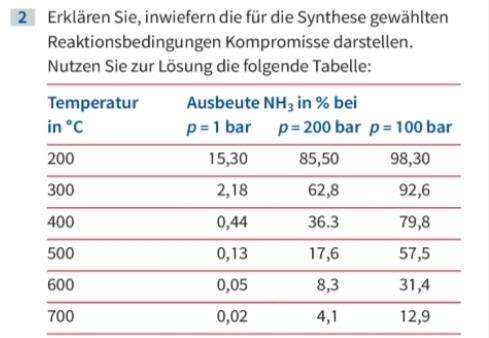
Die Sache mit dem Druck ist ebenfalls nicht unproblematisch. Es ist zwar so, dass die Ausbeute bei zunehmendem Druck steigt (in der Tabelle sind p = 200 bar und p = 100 bar in der Überschrift fehlerhaft vertauscht), aber die Druckerzeugung ist ziemlich teuer. Es ergibt sich somit das Problem, dass es sich irgendwann finanziell nicht mehr lohnt, den teuren Druck zu erhöhen, um damit zwar mehr Ammoniak zu produzieren, den man dann aber billiger verkaufen muss, als die Druckerzeugung gekostet hat.
Aus all diesen Gründen geht man beim Haber-Bosch-Verfahren Kompromisse ein:
Man benutzt einen Oberflächenkatalysator, um die Wahrscheinlichkeit für günstige Zusammenstöße zu erhöhen, wodurch die Temperatur verringert werden kann. Und man arbeitet bei etwa 400 bis 500°C, weil man leider für die Aktivierung des reaktionsträgen Stickstoffs kaum niedriger werden kann (Stickstoff hat eine Aktivierungsenergie von etwa 600°C). Damit das trotzdem funktioniert, setzt man Stickstoff im Überschuss ein.
Beim Druck arbeitet man zwischen 100 und 200 bar, je nachdem, was die Druckerzeugung vor Ort kostet.
Die Tabelle zeigt, dass die Ausbeute theoretisch (also allein vom Reaktionsablauf betrachtet) am größten bei 200°C und 200 bar wäre (98,3%). Aber die Realität verlangt eben Kompromisse...
Alles klar?
LG von der Waterkant
Naja. In der Tabelle hast du Druck und Temperatur als "Variablen" die die Ausbeute der Reaktion beeinflussen. Wie tief müsst ihr das erklären? Kompromiss zwischen Druck und Temperatur.
Die Maximale Ausbeute bekommt man anscheinend bei 200°C und 100 Bar. Jedenfalls im Ramen der Daten der Tabelle.
Wir können weiter ablesen das die Ausbeute mit steigender Temperatur sinkt. Daraus würde ich ableiten dass die Reaktion Exotherm ist bzw. die Rückreaktion endotherm. Kennen wir die Reaktionsgleichung?
Der Druck muss auch abgewägt werden. 100 bar ist in der Tabelle das Optimum. Dazu bräuchte ich ehrlich gesagt die Reaktionsgleichung... Die Sroffmenge auf der Produktseite ist wohl kleiner als auf der Eduk Seite... Aber wieso die Ausbäute bei 200 Bar wieder sinkt? Da kann ich auch nur raten. Ziehmlich sicher ist dass es ein Optimum gibt. Steigt der Druck darüber, sinkt die Ausbeute wieder. Also entstehen vielleicht mehr ungewollte Nebenprodukte.
Beim Haber-Bosch Prozess wird eine Temperatur von 450°C und ein Druck von 200-300bar verwendet. Die Reaktion ist zwar exotherm weswegen die Erhöhung der Temperatur das Gleichgewicht in die Richtung der Edukte bewegen würde. Trotzdem wird so eine hohe Temperatur genutzt damit die Geschwindigkeit der Reaktion sich erhöht. Das ist der Kompromiss bei der Temperatur.
Desto höher der Druck, desto höher die Ausbeute. Das ist, weil wir von 4mol Gasteilchen zu 2mol Gasteilchen gehen. Allerdings wird es natürlich immer teurer desto höheren Druck man verwendet da mehr Energie gebraucht wird.